Разработване на урок по химия на тема „Ароматни въглеводороди

Разработка на урок по химия на тема:
„Ароматни въглеводороди. Бензен.”
Цели и задачи на урока:
-дайте концепцията за арените като една от хомоложните серии на въглеводороди; проучване: методи за получаване на бензен, химични свойства, приложение на бензен въз основа на свойства.
- да разкрият молекулярната, химичната и електронната структура на молекулата на бензена;
-развиват концепцията за връзката между структурата и свойствата на веществата;
- да развият уменията и способностите за работа с фактически материали, да правят логически изводи при сравняване на факти.
Оборудване и материали за урока:
-на демонстрационната маса - бензен.
Форма на урока:
- изучаване на нов материал.
1.Организационен момент. Взаимен поздрав.
Учител.Момчета! Днес започваме да изучаваме друга хомоложна серия въглеводороди. Но преди да започнем да изучаваме нов материал, нека си припомним какви въглеводороди изучавахме.
Задание към класа: групирайте картите (тип хибридизация, ъгъл на връзката, разстояние между въглеродните атоми, формули за клас въглеводороди)
Цел: систематизиране на знанията на учениците в изучаваните класове на HC, за използване при изучаването на нов материал.
2.Формулиране на темата на урока.
Преди година в един от химическите заводи в Китай се случи инцидент.
И така, темата на нашия урок е„Ароматни въглеводороди. Бензен. "Слайд номер 2
Запишете темата на урока в тетрадката си.
3.Изучаване на нов материал.
Въглеводородите от тази хомоложна серия имат исторически установено име - ароматни, което теполучени поради факта, че представителите имат характерна миризма (понякога приятна, понякога не.)
В съвременния живот това са производни на бензола: тамян, дихлорвос, ванилин, багрила, нафталин, освежител за въздух.
Когато изучаваме въглеводороди, ние се придържаме към строг план. Слайд #3
(Въз основа на видеото учениците говорят за физичните свойства, за ефекта върху тялото, за ефективните средства за неутрализирането им, използването на бензен)
(отговорите на ученика + предварително подготвени съобщения на ученика)
- Бензолът е безцветна течност, практически неразтворима във вода, с ароматна миризма, но парите на бензена са отровни, температура на кипене = + 80,10С, точка на топене = + 5,50С, по-лека от водата, поради което не се смесва с нея, дестилира се при кипене
(картите са поставени на дъската:+80.10С, +5.50С)
При кратко вдишване на бензенови пари не настъпва незабавно отравяне, поради което доскоро процедурата за работа с бензол не беше особено регулирана.
В големи дози бензолът причинява гадене и световъртеж, а в някои тежки случаи отравянето може да бъде фатално. Първият признак на отравяне с бензол често е еуфория. Бензоловите пари могат да проникнат през непокътнатата кожа. Ако човешкото тяло е изложено на продължително излагане на бензол в малки количества, последствията също могат да бъдат много сериозни. В този случай хроничното отравяне с бензол може да причини левкемия и анемия. Силен канцероген.
- Най-ефективното средство за неутрализирането им.
Самият бензен и неговите производни са химически неактивни, способни да се натрупват в животински организми, почви, копка, тиня, мъх. Водната среда обикновено се почиства чрез запълване на засегнатата зона с голямо количество пореста масасорбент - варовик, пясъчник, доломитни чипове и др. След това, ако е възможно, сорбентът се изгребва и заравя. Почвите не се почистват - просто се покриват с глина или се отстранява горният слой и се покрива отново.
Няма универсални химични агенти за неутрализиране на ароматни въглеводороди.
Бензолът е най-важната суровина за нефтохимическата промишленост" href="/text/category/himicheskaya_i_neftehimicheskaya_promishlennostmz/" rel="bookmark"> химическата промишленост, тъй като се използва както като изходен реагент за синтеза на голямо разнообразие от съединения, така и като разтворител за други реакции (бензенът разтваря почти всички органични съединения, той е вид "органичен" вода"). Слайд № 4
Момчета, погледнете отново внимателно плана за изследване на въглеводородите и каква точка можете да разкриете въз основа на знанията си?
Какви методи за доставка можете да предложите.
(Учениците пишат тримеризация на ацетилен и ароматизиране на хексан на дъската.)
Историята на откриването на бензена е много интересна.
-Историческа справка. (Съобщение на ученика.) Слайд номер 4
За да отворите бензен, както често се случва, случайността помогна. Започвайки от 1910 г. в Лондон, осветителният газ се използва за осветяване на улиците с фенери. Получава се чрез суха дестилация на въглища и се съхранява под налягане в херметични съдове. В същото време течността се натрупва в съдовете, особено изобилно в студено време. Майкъл Фарадей започва да го изучава и на 18 май 1825 г. изолира съединение на водород с два въглерода и му приписва неправилната формула C2H. Истинската формула е установена, след като е било възможно да се определи нейното молекулно тегло.
Задание на класа. Нека станем изследователи за минута и се опитаме да изведем формулата на бензена
Плътността на парите на това вещество във въздуха е 2,69. Масова част на въглерод - 92,3%, водород - 7,7%. Определете молекулната формула на веществото.
И така, формулата на веществото, открито от Майкъл Фарадей, е C6H6.
• Обща формула - СnН2n-6
Но вие и аз си спомняме, че има теория за химическата структура, една от разпоредбите на която гласи:
"Свойствата на веществата зависят от химическата структура на техните молекули"
и ние разбираме, че познаването на една молекулна формула на дадено вещество не е достатъчно, трябва да знаете и структурата на молекулата, за да прецените нейните свойства. Следователно нашата задача сега е да се опитаме да открием тази структура.
След откриването на бензена, дискусията за неговата структура се води в науката много дълго време. За нас е по-лесно - имаме някои факти, въз основа на които предлагам да съставите структурна формула за бензен.
Задача към класа: нека се опитаме да съставим структурна формула, която да съответства на получената формула C6H6
(Учениците самостоятелно в тетрадка, след това на дъската записват структурните формули на бензена, където се взема предвид, че това съединение е ненаситено съединение, валентността на въглерода:
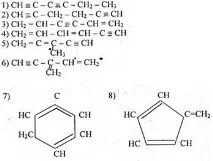
Има много проста реакция, която ви позволява бързо и надеждно да определите наличието на двойни или тройни връзки в ненаситени въглеводороди. Който?
Това е добавянето на бром чрез множество връзки или с разтвор на калиев перманганат.
Достатъчно е ненаситеният въглеводород да се разклати няколко пъти с бром или калиев перманганат, тъй като разтворът става безцветен.
Видео. Демонстрационен опит. (бензол с разтвор на калиев перманганат)
Заключение: бензол с разтвор на калиев перманганат - няма ефект!
Очевидно бензенът има циклична структура.
Слайд номер 6 Формула на Кекуле
С двойни връзки? Но решениетокалиев перманганат.
Заключение: че три двойни връзки, събрани на място в един шестчленен пръстен, се държат някак си по нов начин.
(На картон:sp2 120° 0,140 nm)
Споровете около теорията за структурата на бензена спряха само преди няколко десетилетия. Какви са настоящите идеи за електронната структура на бензена?
По този начин химичните връзки в бензена не са единични и не двойни, а, както се казва, един и половина, междинен характер. Тези връзки се наричат още ароматни, те са по-силни от P-връзките (следователно бромната вода не се обезцветява - бромните атоми не се прикрепват).
За да се покаже равномерното разпределение на електроните, често се изобразява като шестоъгълник с кръг вътре:
Такава структура се нарича бензенов или ароматен пръстен. А въглеводородите, в състава на молекулите, които съдържат ароматно ядро, се наричат ароматни въглеводороди.
Какъв тип реакции ще бъдат характерни за бензена?(предположения на учениците)
Наистина бензенът влиза както в реакции на добавяне, така и в реакции на заместване, но
2) Реакциите на присъединяване протичатпо-трудноотколкото при ненаситените въглеводороди
Ако в молекулата на бензена един от водородните атоми бъде заменен с въглеводороден радикал, тогава в бъдеще водородните атоми при втория, четвъртия и шестия въглероден атом ще бъдат заменени първи.
Въпрос към класа: Защо?
Оказва се, че 6 р-електрона създават толкова силна единична система от р-връзки, че е по-трудно да се скъса, отколкото да се скъса връзката между въглероден атом и водород (изисква се повече енергия).
Изомерияслайд №7
Арените се характеризират с изомерия в позициите на няколко заместителя.
4.Затвърдяване на изученотоматериал.
Образованието не се състои в количеството знания, а в пълното разбиране и умелото прилагане на всичко, което човек знае.
И така, моментът на истината дойде в нашия урок!
Давам ви тест, състоящ се от 9 въпроса, трябва да отговорите на въпросите, да запишете само номера на верния отговор в тетрадката си, ще получите деветцифрено число.
1. Обща формула на ароматни въглеводороди:
1) CnH2n-2; 3) CnH2n;
2) CnH2n-6; 4) CnH2n+2.
2. Бензолът не е характерен за:
1) течно агрегатно състояние;
2) характерна миризма;
3) точка на кипене 80,1º C;
4) добра разтворимост във вода.
3. Разстоянието между въглеродните атоми в бензена е намалено поради:
1) цикличната структура на молекулата;
2) подреждане на хибридни орбитали в една равнина;
3) влиянието на π-електронния облак;
4) равномерно разпределение на електронната плътност.
4. Веществата с обща формула CnH2n-6 принадлежат към класа:
1) алкани; 3) алкини;
2) алкени; 4) арени.
5. В молекулата на бензена се образуват шест въглеродни атома:
1) правилен шестоъгълник;
2) неправилен шестоъгълник;
3) триъгълник със странични разклонения;
4) квадрат със странични разклонения.
6. Състоянието на хибридизация на въглеродните атоми в молекулата на бензена:
2) sp2; 4) sp и sp2.
7. Когато бензенът се хлорира при силна светлина, се оказва:
2) 1, 2, 3-трихлоробензен;
8. Когато бензенът взаимодейства с бром в присъствието на катализатор (FeBr3), се оказва:
1) бромобензен; 2) хексабромоциклохексан;
3) 1,3,5-трибромобензен; 4) 1,2-дибромобензен.
9. Бензенът, подобно на ненаситените въглеводороди, реагира:
1)полимеризация; 3) окисляване с разтвор на калиев перманганат;
2) хидрохалогениране; 4) хидрогениране.
Слайд номер 8 (ключ за тестване)
Взаимна проверка. Обобщаване.
5. Домашна работа: § 7p. Упражнение номер 4 (писмено).
1.. Химия 10 клас (основно ниво)
2. сайт училище-сборник. *****
2. Shulpin 9, No 9, p. 23–27.
4. Електронно издание "Химия. 8-11 клас. Виртуална лаборатория"
5. http://ru. уикипедия. org/wiki/VX
6. Видеокасети Химия (Органична химия)