Решаване на задачи по pH и хидролиза
Решаване на проблеми приpH
Пример за задача (фрагмент от Таблица 1):
1.Определяне на разтворената среда чрез рН стойност
а)Изчисляване на моларната концентрация на: а) йониН + ;b)йониOH -
[H + ] \u003d 10 - pH mol / l
[H + ] = 10 –2,4 = 4,0∙10–3 mol/l
[OH – ] = 10 pH–14 mol/l
[OH – ] = 10 2,4–14 = 2,5∙10 –12 mol/l
c)Изчисляване на моларна концентрацияHCl(ако средата е кисела)илиNaOH(ако средата е алкална)
2.Определяне на средата на разтвора чрез стойносттарОН
а)Изчисляване на моларната концентрация на: а) йониН + ;b)йониOH -
[H + ] = 10 pOH–14 mol/l
[H + ] \u003d 10 10.9-14 \u003d 7.9 10 - 4 mol / l [
[OH -] \u003d 10 - pOH mol / l
[OH – ] = 10–10, 9 = 1,3∙10–1 1 mol/l
c)Изчисляване на моларната концентрацияHCl (ако средата е кисела) или NaOH (ако средата е алкална)
3.НамеретеpH и pOHc1 MразтворH2SO4 (yуравнение на дисоциация: H2SO4 → 2 H + + SO
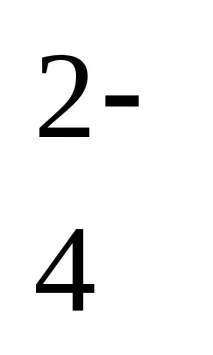
[H + ] \u003d 2 0,023 \u003d 0,046 mol / l
pH = –lg[H + ]; pOH = 14 - pH
pH = –lg0,046 = 1,337; рОН = 14 - 1,337 = 12,663
4.НамиранеpH и pOHc2 МразтворBa(OH)2 (yуравнение на дисоциация: Ba(OH)2 → Ba 2+ + 2OH − )
[OH -] \u003d 2 0,032 \u003d 0,064 mol / l
pOH = –lg[OH – ]; pH = 14 - pOH
pOH = –lg0,064 = 1,194; pH = 14 - 1,194 = 12,806
n0(OH -) = 0.064 64 = 4.096 mmol
n(H + ) =n0(H + ) –n0(OH − ),
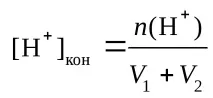
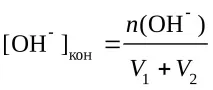
pH = 14 + lg[OH − ]кон
n(OH-) = 4.096 - 1.012 = 3.084 mmol,
мол/л,
pH = 14 + lg 0,0359 = 12,56
6.Намиране[H + ], pH и pOH вcMразтвор на слаба киселина, чиято константа на дисоциация еKa
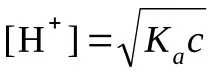
pH = –lg[H + ]; pOH = 14 - pH
mol/l;
pH \u003d -lg (3,82 10 -4) \u003d 3,42; рОН = 14 - 3,42 = 10,58
Решаване на проблеми с хидролизата
1.Уравнения на дисоциациясоли
M
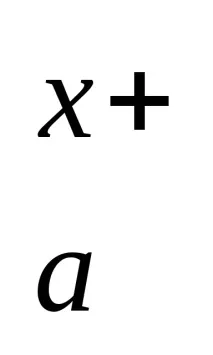
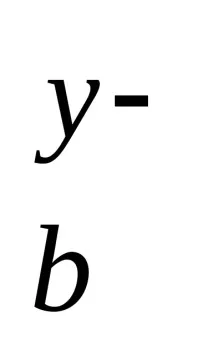
M
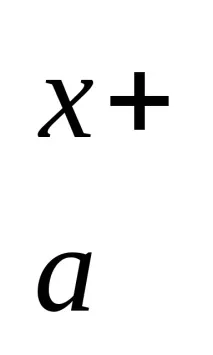
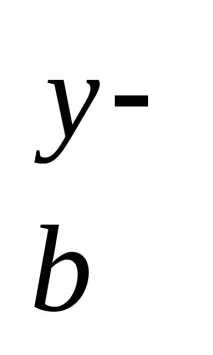
Fe14(SO15)3
Fe2(SO4)3 → 2 Fe 3+ + 3 SO
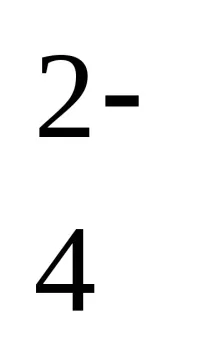
M
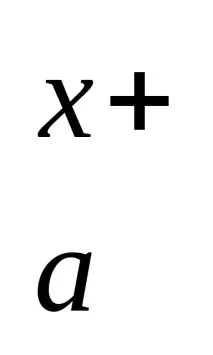
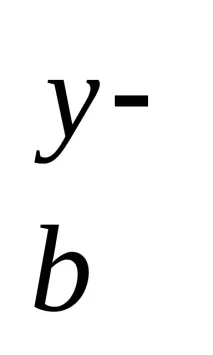
виж таблицата. „Силен
киселини и основи»
виж таблицата. "Силни киселини
Fe19(SO20)3
3.Определяне натипове хидролиза
бази и сили. за теб
4.Кратки йонни уравнения на хидролиза
сили. бази и сили. за теб
бази и сили. за теб
Изчисляване на pH (KaиKb– вижте таблицата „Константи на последните етапи на дисоциация…“)
бази и сили. за теб
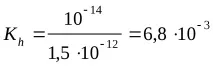

pH \u003d -lg0,0184 \u003d 1,74
сили. основи и сл. за теб
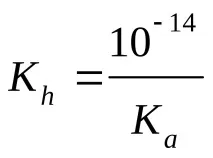
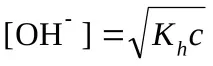
сл. бази и сили. за теб
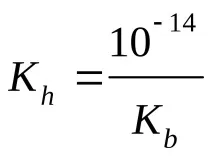
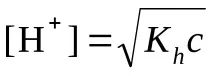
сили. бази и сили. за теб
сл. основи и сл. за теб:
а) солна формула Μ


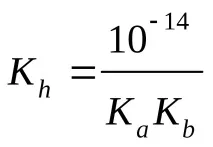
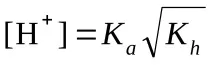
б) солна формула Μ

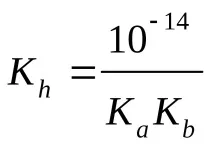
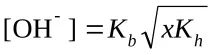
c) солна формула Μ
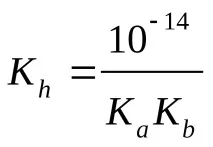
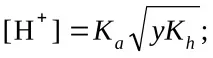
6.Определяне на разтворената среда чрез рН стойност