Енергийни схеми за образуване на молекули и йони, задачи 76-80
Енергийни схеми за образуване на водородната молекула и йон
Задача 76. Начертайте енергийната схема за образуване на молекулна неH 2 - и молекула H 2 с помощта на метода на молекулярната орбита. Къде енергията на свързване е по-голяма? Защо?Решение: а) Енергийна схема за образуване на молекулния йон H 2 - :
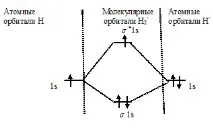
Тъй като редът на връзката е 0,5, йонът H2 трябва да бъде енергийно стабилен, тъй като тук от трите електрона, които трябва да бъдат поставени на MO, два ще заемат свързването ( 1s), а един - разхлабване ( * 1s) MO. Следователно образуването на H2-йон ще бъде придружено от освобождаване на енергия. Наистина, H2 йони се получават експериментално.
б) Енергийна схема за образуване на молекулата Н2:
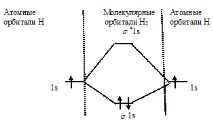
Тъй като редът на връзката е 1, молекулата Н2 може да съществува. Енергията на свързване в молекулата на Н2 е по-голяма, отколкото в молекулния йон Н2, тъй като редът на връзката на молекулата на водорода е по-голям от Н2, отколкото в молекулния йон Н2.
Метод на валентната връзка
Задача 77. Какви електрони на борния атом участват в образуването на ковалентни връзки? Как методът на валентните връзки (BC) обяснява симетричната триъгълна форма на молекулата BE3?Решение: Атом на бор на външно енергийно ниво съдържа два s- и един p-електрон (2s 2 2p 1 ). В нормално състояние борът проявява ковалентност, равна на 1; поради несдвоения р-електрон той може да образува ковалентна връзка според обичайния механизъм. Във възбудено състояние на борния атом 2s-електронът преминава към свободната 2p-орбитала и в този случай се образуват три несдвоени електрона (2s 1 2p 2 ):
Запълването на външното енергийно ниво на борния атом восновно условие:
В това състояние валентността (спинвалентността) на борния атом е 1.
Запълването на външното енергийно ниво на борния атом във възбудено състояние:
В това състояние валентността (спинвалентността) на борния атом е 3.
Борният атом образува молекула на борен флуорид BF3 поради припокриването на електронните орбитали, заети от несдвоени електрони, с електронните орбитали на флуора. В този случай атомът на бора запазва една свободна орбитала, поради което може да образува четвърта връзка по донорно-акцепторния механизъм.
Борният атом хибридизира една s-орбитала и две p-орбитали. В този случай в резултат на линейна комбинация от три начални орбитали възникват три хибридни sp 2 орбитали. Когато sp 2 орбиталите на борния атом се припокриват с орбиталите на три флуорни атома, се образуват три връзки, които са еквивалентни по дължина и енергия. Те са разположени в една и съща равнина под ъгъл 120 0 един спрямо друг. Молекулите, в които валентните орбитали на централния атом са в състояние на sp 2 хибридизация, имат формата на плосък триъгълник.
Енергийни схеми за образуване на молекулите на кислорода, флуора и азота
Задача 78. Начертайте енергийната схема за образуване на молекулата O2 с помощта на метода на молекулярната орбитала (МО). Как МО методът обяснява парамагнитните свойства на кислородната молекула?Решение:
От гледна точка на метода МО, електронната структура на молекулата O2 може да бъде представена по следния начин:
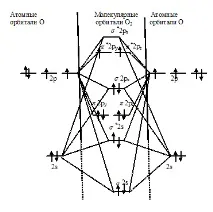
От енергийната схема на образуване на молекулата O2 следва, че тя е парамагнитна, тъй като на *2py и *2pz има несдвоени електрони
Задача 79. Начертайте енергийната схема за образуване на молекулата F2 с помощта на метода на молекулярната орбитала (МО). Колко електрони са при свързване и разхлабванеорбитали? Какъв е редът на връзката в тази молекула?Решение: От гледна точка на МО метода електронната структура на молекулата F2 може да бъде представена по следния начин:

От енергийната схема на образуване на молекулата F2 следва, че има шест електрона в свързващите орбитали и четири сдвоени електрона в разхлабващите орбитали. Редът на връзката е равен на разликата между броя на електроните в свързващите и разхлабващите орбитали, разделена на две. В една флуорна молекула редът на връзката е равен на единица:
Задача 80. Начертайте енергийната диаграма на образуването на молекулата N2 по метода на молекулярната орбитала (МО). Колко електрона има в свързващите и антисвързващите орбитали? Какъв е редът на връзката в тази молекула?Решение: От гледна точка на МО метода електронната структура на молекулата N2 може да бъде представена по следния начин:
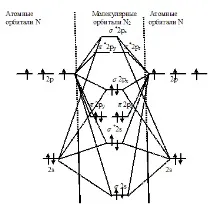
От енергийната схема на образуване на молекулата N2 следва, че на свързващите орбитали има шест електрона, а на разхлабващите орбитали няма. Редът на връзката е равен на разликата между броя на електроните в свързващите и разхлабващите орбитали, разделена на две. В азотна молекула редът на връзката е три: