Хидролиза на вицинални дихалогенни производни или халохидрини
Окисляване на алкени с воден разтвор на калиев перманганат или водороден прекис
3. Хидратация на а-оксиди
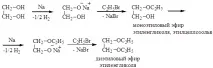
В резултат на реакцията на алкохолат и етиленов оксид се образуват съединения от типа ROCH2CH2OH -целозолв:
Каталитична редукция на двукиселинни естери
Възстановяване на диалдехид
Физически свойства
Поради наличието на междумолекулни и вътрешномолекулни водородни връзки и голям брой полярни групи, гликолите имат по-високи точки на кипене от едновалентните алкохоли и са силно разтворими във вода. Диолите с ниско молекулно тегло са гъсти течности, диолите с високо молекулно тегло са твърди вещества.
Химични свойства
Химичните свойства на диолите са подобни на тези на едновалентните алкохоли, но те могат да реагират с едната или двете хидроксилни групи. С алкалните метали те образуват пълни и непълни гликолати, а с минерални и органични киселини - пълни и частични естери.
Образуване на гликолат
Отличителна черта на гликолите е реакцията с меден хидроксид за образуване на меден гликолат (качествена реакция към вицинални диоли)
Образуване на естер
Образуване на етер
Реакции на дехидратация
Гликолите се характеризират с вътремолекулни и междумолекулни реакции на дехидратация
Нека специално разгледаме дехидратацията на α-дву-третични гликоли (пинакони) в присъствието на сярна киселина, което води до образуването на пинаколини:
Това пренареждане се наричапинаколин. Дехидратацията на пинаконите над алуминиевия оксид води до алкадиени.
Окисляване
Двувалентните алкохоли лесно се окисляват:
Индивидуални представители
Етилен гликолипропилен гликолсе използват широко в производството на антифриз. Етиленгликолът се използва и при синтеза на полимерни материали - полиетилен терефталат (лавсан), ненаситени полиестери, полиуретани, алкидни полимери и др. От него се получава етилен гликол динитрат (за производство на експлозиви и барут), както и етилен гликол моно- и диацетати, които са добри разтворители.
Моноетери на етилен гликол с обща формула ROCH2-CH2OH се наричат целозолви. Името "cellosolve" се отнася до 2-етоксиетанол. Тези вещества имат добри свойства на разтворител за целулозни етери.Бутилцелозолве добър разтворител; използва се в течности за хидравлични спирачки и се добавя към авиационно гориво като антифриз.
Карбитолите, които са моноалкилови етери на диетилен гликол, се използват като разтворители, както и в производството на лакове. Те се получават чрез взаимодействие на целозолв с еквивалентно количество етиленов оксид.
Въглеродни восъци(полимери с различни молекулни тегла) се получават чрез реакция на етиленов оксид свик-диоли (напр. етилен гликол). Carbowaxes се използват като смазочни масла, компоненти на мехлеми и течна фаза в газо-течна хроматография.
ТРИХИДОМНИ АЛКОХОЛИ
Предшественикът на хомоложната серия от тривалентни алкохоли е глицерол (пропантриол-1,2,3). Това е вискозна нетоксична течност с т.к. 290°C, хигроскопичен, смесим с вода. Използва се в хранително-вкусовата и текстилната промишленост за производство на пластмаси и лакове, барут, експлозиви, козметика и медицински вещества.
Методи за получаване
Хидролиза на мазнини
Дълго време единственият източник на глицерин впроизводство на сапун (хидролиза на мазнини - естери на глицерин и висши карбоксилни киселини), обслужвани в промишлен мащаб.
Пропилен
В момента глицеринът се получава от пропилей по схемата:
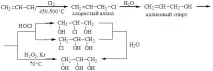
3. От ацетилен:
Химични свойства
По своите химични свойства глицеринът не се различава от моно-, двувалентни алкохоли. С алкалните метали, хидроксидите на желязото, медта, калция и бария образуват глицерати. С HCl, HBr дава моно- и дихалогенидрини, с HI - трийодопропан. Под действието на PCl3, PI3, PBr3 всички хидроксилни групи се заместват с халоген. Когато се дехидратира, глицеролът образува акролеин (ненаситен алдехид, образуването на който наблюдаваме при изгаряне на мазнините):
Най-интересни са естерите на глицерола и киселините (карбоксилна и минерална).
С карбоксилните киселини глицеролът образува естери - мазнини от животински и растителен произход:
Естерите на минералните киселини също са интересни, например пълен естер на азотна киселина и глицерол - глицерол тринитрат, нитроглицерин (тривиалното име е химически неправилно) - експлозив, използван за производство на динамит и бездимен барут. Динамитът, импрегнирана с нитроглицерин диатомит, беше предложен от Нобел, което му донесе голяма печалба, която той завеща на годишните награди на учените (Нобелови награди).
Глицерол тринитрат се използва в медицината като вазодилататор. Самият глицерол играе важна роля в метаболизма, е част от липидите.
Ненаситени алкохоли
Най-простият ненаситен алкохол - винил - е нестабилен и се превръща в ацеталдехид, никога не е бил изолиран в отделно състояние:
Други винилови алкохоли също претърпяват подобна трансформациясъответните карбонилни съединения. Известни са обаче етери и естери на винилови алкохоли, те могат да бъдат получени чрез добавяне на алкохоли и карбоксилни киселини към ацетилени:
Виниловите алкохолни естери намират приложение при получаването на много промишлено важни полимери.
Алил алкохол може лесно да се получи чрез хидролиза на алил хлорид:
Той влиза в най-често срещаните реакции на двойна връзка и, както се очаква от химичните свойства на алилхалидите, е значително по-реактивен от наситените първични алкохоли с реагенти за разцепване на С-О връзка:
Двойната връзка не влияе на реактивността на хидроксилната група, ако те са разделени от две или повече метиленови групи, както в бутен-3-оле-1: CH2=CH-CH2-CH2OH
Лекция №16.Феноли
Едноатомни феноли. Изомерия. Номенклатура. Методи на производство: от арилхалогениди, сулфонови киселини, амини. Промишлен метод за получаване на фенол от кумол. Химични свойства. Киселинност. Причини за стабилизирането на фенолатния йон. Влияние на заместителите върху киселинността на фенолите. Фенолни етери и естери. Реакции на електрофилно заместване (халогениране, нитриране, сулфониране, нитрозиране). Реакция с формалдехид. Фенол-формалдехидни смоли.
Специално място в органичната химия заематфенолите:
Фенолът е тривиално наименование, което също е прието в номенклатурата на IUPAC. Много феноли запазват тривиални имена:
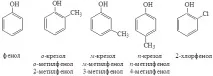
Според броя на хидроксилните групи фенолите се делят на едно-, дву-, три- и многовалентни.
Методи за получаване на феноли
Коксуване на въглища
Основната цел на този процес е да произвеждаметалургичен кокс. Страничните продукти са течни продукти на коксуване и газ. Чрез дестилация на течни продукти на коксуване, наред с бензен, толуен и нафталин, се получават фенол, тиофен, пиридин и техните хомолози, както и по-сложни аналози с кондензирани ядра. Делът на въглищния фенол в сравнение с получения куменен метод е незначителен.