Химични източници на електрически ток
Химически източници на електрически ток или галванични клетки преобразуват енергията, освободена по време на редокс реакции, в електрическа енергия. Галваничните клетки служат като източници на постоянен ток. Те се делят нахимични иконцентрационни.
Най-простият химически галваничен елемент може да бъде съставен от два метални електрода с различни електродни потенциали и свързани в затворена верига.
Електрод, който има по-ниска стойност на потенциала на електрода, ще претърпи процес на окисление. Такъв електрод иначе се наричаанод.
Електродът с по-висока стойност на електродния потенциал ще премине процес на възстановяване. Такъв електрод иначе се наричакатод.
Нека разгледаме по-подробно принципа на работа на галваничните клетки, използвайки примера на елемент, съставен от цинкови и медни електроди. Такъв елемент иначе се наричаелемент на Якоби-Даниел (фиг. 94).
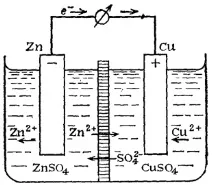
Фиг. 94. Схема на медно-цинкова галванична клетка
Всеки електрод се състои от метална пластина, потопена в солен разтвор: съответно ZnSO4 и CuSO4.
Солните разтвори са разделени един от друг чрез пореста преграда, през която металните йони и SO4 2- могат лесно да преминат. Често вместо пореста преграда се използва "солен мост " - извита стъклена тръба, пълна с наситен разтвор на KCl (фиг. 95). В този случай електродите не се допират един до друг, всеки от тях е в отделен съд, които са свързани с помощта на солен мост.
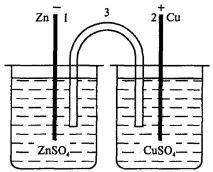
Ориз. 95. Схемамедно-цинков елемент със солен мост: 1 - цинкова плоча; 2 - медна плоча; 3 - солен мост
В този случай процесът на окисление протича върху цинковия електрод:
в резултат на което цинковите йони от плочата преминават в разтвор. Излишните електрони преминават през метален проводник от цинкова плоча към медна и възстановяват Cu 2+ йони, съдържащи се в разтвора
които се отлагат върху плочата под формата на неутрални атоми. Останалите свободни сулфатни йони на медния електрод и Zn 2+ йони на цинковия електрод, които се появиха в излишък, се движат един към друг през пореста преграда или солев мост. Така във веригата се пренасят електрически заряди и възниква електрически ток.
В този елемент електрическата енергия се получава в резултат на химическа реакция.
Основната характеристика на галваничния елемент еелектродвижеща сила (емф), от която зависи силата на тока във веригата. Тя е равна на разликата в електродните потенциали
където E1 и E2 са анодните и катодните потенциали, съответно.
За галваничен елемент на Якоби-Даниел електродвижещата сила е
Колкото по-висока е стойността на емф. елемент, толкова по-голям е токът в неговата верига.
Според уравнението на Нернст потенциалът на медните и цинковите електроди се изчислява по формулите:
ECu=ECu0+
EZn = EZn 0 +
Изваждайки второто уравнение от първото, получаваме израз за изчисляване на емф. медно-цинкова галванична клетка
емф = ECu 0 – EZn 0 + =
= ECu 0 – EZn 0 +
За всеки друг елемент, съставен от два метални електрода и който се основава на химическа реакция, електродвижещата сила може да се изчисли по формулата:
емф= E2 0 – E1 0 +
където E2 0 и E1 0 са стандартните електродни потенциали, съответно на катода и анода; n2 и n1 са стойностите на зарядите на йоните, участващи в полуреакциите, които се случват на катода и анода; a2 и a1 са активността на металните йони в разтворите съответно на катода и анода).
За температура от 298 K, при заместване на стойностите на константите R и F и преминаване от натурален логаритъм към десетичен логаритъм, нашето уравнение ще бъде написано по различен начин:
емф = E2 0 – E1 0 + 0,059
Галваничните клетки могат да бъдат маркирани като диаграма. Отляво обикновено се показва електрод или полуклетка с по-нисък електроден потенциал (анод), а отдясно с по-висок електроден потенциал (катод).
При записване на електроди първо се посочва твърдата фаза (например метал в случай на метален или редокс електрод), а след това веществата, разтворени в течната фаза. Фазите са разделени една от друга с една вертикална линия. Ако една фаза съдържа няколко компонента, те се разделят със запетаи.
Интерфейсът между разтворите на два електрода е изобразен с пунктирана вертикална линия или две плътни линии ½½ (ако разтворите са разделени един от друг чрез солен мост).
Съгласно правилата по-горе, веригата на елемента Jacobi-Daniel изглежда така:
Галваничният елемент може също да бъде съставен от два редокс електрода с различни стойности на редокс потенциала. Такива клетки иначе се наричат редокс галванични клетки. Те също се отнасят до химически галванични елементи, т.к. тяхното действие се основава на протичането на химична реакция.
Галванична клетка, в която източникът на енергия не е химическа реакция, а работаподравняването на концентрациите (активностите) на йони се нарича концентрация. Може да се състои от два еднакви метални електрода, потопени в разтвори на една и съща сол, но с различна концентрация (активност) на метални йони (фиг. 96), например:
Zn ½ ZnSO4 ½½ ZnSO4 ½ Zn или Ag ½ AgNO3 ½½ AgNO3 ½ Ag
Самият електрод се зарежда отрицателно.
На електрода, потопен в по-концентриран разтвор, напротив, се отлагат метални йони и той е положително зареден. Така на двата електрода протичат процеси, които водят до изравняване на концентрацията на метални йони в разтворите.
В този случай потенциалите на електродите са равни:
E1 = E0 + ; E2 = E0 +
Като извадим първото уравнение от второто, получаваме формула за изчисляване на емф. от концентрационния елемент:
емф = E2 – E1 =
емф =
Концентрационният елемент ще работи, докато активностите на металните йони в двата разтвора са равни; при a1 = a2 неговият e.m.f. ще бъде равно на 0.