Изоморфизъм, полиморфизъм и алотропия
Вещества с обща химична формула, които имат кристална решетка от същия тип, се наричат изоморфни. Изоморфизъм се открива например в натриевия нитрат NaNO3 и калциевия карбонат CaCO3, който е под формата на минерала калцит. И двете вещества имат ромбоедрична кристална структура.
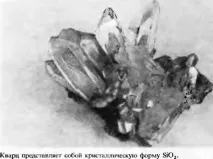
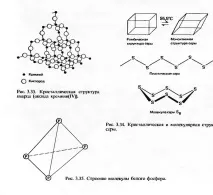
Способността на едно съединение да съществува в две или повече кристални форми се нарича полиморфизъм. Пример за полиморфно съединение е силициев диоксид-силициев (IV) оксид SiO2. Той има рамкова ковалентна структура, в която силициевите атоми са свързани с четири кислородни атома в тетраедрична опаковка (фиг. 3.33). Кварцът е кристалната форма на силициев диоксид, в която той съществува при обикновени температури. Има шестоъгълна структура. При високи температури кристалната структура на силициевия диоксид се трансформира в ромбична и след това в кубична форма:
Температурата, при която една форма на материя преминава в друга, се нарича температура на прехода.
Ако даден елемент може да съществува в две или повече твърди форми (кристална или аморфна), тогава се счита, че проявява алотропия. Различните форми на един и същи елемент се наричат алотропи. Алотропите съществуват в около половината от всички елементи.
Например въглеродът съществува под формата на диамант или графит. Сярата съществува в две кристални форми - ромбична и моноклинна - в зависимост от температурата (виж също Глава 6). И двете му кристални форми са примери за молекулярни кристали. Молекулите в тях са гофрирани цикли, всеки от които съдържа осем ковалентно свързани серни атома (фиг. 3.34). Твърда сяра можесъществуват в третата алотропна форма, като пластична сяра. Тази форма на сярата е нестабилна. Състои се от дълги вериги от серни атоми, които се разпадат при стайна температура и отново образуват S8 молекули, които кристализират в ромбична решетка.
Фосфорът може да съществува в три алотропни форми. Най-стабилният от тях е червеният фосфор (виж също гл. 6). Червеният фосфор има скелетна кристална структура, в която всеки атом е ковалентно свързан с три други фосфорни атома. Белият фосфор е молекулен кристал. Всяка от неговите молекули съдържа четири фосфорни атома, ковалентно свързани в тетраедрична структура (фиг. 3.35). Третият алотроп, черен фосфор, се образува само при високо налягане. Съществува като макромолекулна слоеста структура.