КРЪВ, ТЪКАННА ТЕЧНОСТ, ЛИМФА
Пигментите са вещества с различна химична структура, които имат определен цвят и оцветяват средата, в която се намират. Цветът на пигментите се дължи на наличието в техните молекули на хромофорни групи, които абсорбират светлина с определена дължина на вълната. Физиологичните функции, изпълнявани от пигментите, са разнообразни. Основните са преносът и отлагането на 02 и CO2, участието в тъканното дишане и в окислително-възстановителните реакции. В процеса на еволюция на вътрешната среда се появиха няколко вида такива пигменти. Всички те са металосъдържащи протеини.
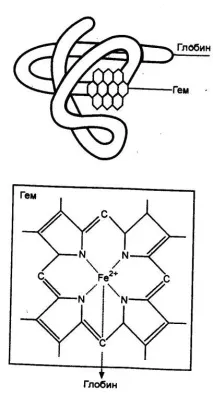
Ориз. 7.7 Молекула на хемоглобина и формула на хема
Хемоглобин, миоглобин, хемеритин, хлоркруорин съдържат желязо, хемоцианин - мед, гемованадин - ванадий. Най-важните от пигментите сахромопротеините.Това са протеини, чиято молекула се състои от протеин и оцветена простетична група. Като простетична група много пигменти съдържат метални производни на порфирините.
Порфиринитепривличат специално внимание. Това се дължи на факта, че те са включени в основния кръвен пигмент -хемоглобини в зеления пигмент на растенията -хлорофилВ кръвната плазма на безгръбначни животни са открити железен порфирин, дихателни пигменти. Кръвта и лимфата на много безгръбначни съдържат сини или зеленикаво-сини дихателни пигменти, съдържащи мед. Медта и цинкът са включени в оцветения протеинцитокупреин.
Хемоглобин.Хемоглобинът е най-често срещаният кръвен пигмент. Намира се в еритроцитите на всички гръбначни и някои безгръбначни (червеи, мекотели, членестоноги, бодлокожи), както и в кореновите възли на някои бобови растения. Много свойства на хемоглобина зависят от характеристиките на неговата химична структура. Молекулна масахемоглобинът на човешките еритроцити е 64,5 kDa.
В един еритроцит има около 400 милиона молекули хемоглобин. Хемоглобинът се състои от протеинглобини пигментната групахем, свързани помежду си чрез хистидинов мост (фиг. 7.7) в съотношение съответно 96 и 4% от масата на молекулата. Молекулата на хемоглобина съдържа четири еднакви групи хем. Глобинът е протеин от албуминов тип.При различните животински видове той се различава по своя аминокиселинен състав, което определя разликата в свойствата на хемоглобина. Структурата на хема е еднаква при всички животински видове. Той е изграден от пиролови пръстени и съдържадвуферентно желязо(фиг. 7.7). Именно желязото играе ключова роля в активността на хемоглобина, като неговата активна procmemuchesky група.Една от валентностите на желязото се реализира, когато хемът се свързва с глобин, O2 или други лиганди - вода, CO2, азиди - се присъединяват към втория. Белтъчните и протезните части на молекулата са не само свързани, но и постоянно оказват силно влияние една върху друга. Глобинът променя свойствата на хема, като определя способността му да свързва киселинните видове. От своя страна хемът осигурява устойчивостта на глобина към действието на физични фактори, разцепване от ензими и др.
Количеството хемоглобин в кръвта е обект на индивидуални колебания. Средната нормална стойност за човек се счита за 140 g/l кръв, което например за индивид с тегло 65 kg е повече от 600 g. Изчислено е също, че 1 g хемоглобин съдържа 3,5 mg желязо, което означава, че във всички еритроцити на тялото той е 2,1 g.
В процеса на пренос на кислород хемоглобинът се превръща воксихемоглобин(HbO 2 ). За да се подчертае конкретно, че валентността на желязото не се променя с това съединение, реакциятаСвързването на кислорода с хемоглобина не се нарича окисляване, аоксигениране.Обратният процес се наричадеоксигениране.В случай, че е необходимо да се подчертае, че хемоглобинът не е свързан с кислород, широко се използва терминътдезоксихемоглобин.
Оксихемоглобинът (HbO2)има яркочервен цвят, който определя цвета на артериалната кръв. Образуването на оксихемоглобин става в капилярите на белите дробове, където напрежението на O2 е високо. Количеството хемоглобин в еритроцитите определякислородния капацитет на кръвта.Следователно, човешка кръв, съдържаща около 600 g оксихемоглобин, като е наситена изцяло с кислород, може да свърже повече от 800 cm 3O2Кислородният капацитет се изразява като количеството кислород, свързано с 1 cm 3 кръв. Съответно, кислородният капацитет на нормалната кръв, съдържаща 0,14 g хемоглобин във всеки кубичен сантиметър, е около 0,190 cm 3 02.
За разлика от капилярите на белите дробове, в капилярите на тъканите има по-малко кислород, напрежението му е по-ниско и тук оксихемоглобинът се разпада на хемоглобин и кислород. Хемоглобинът, който се е отказал от кислорода, се наричаредуциран,илиредуциран хемоглобин(H b ). Именно той определя черешовия цвят на венозната кръв. Следователно, хемоглобинът е вид химично вещество, което влиза в обратима комбинация с кислорода при всяко напрежение. Способността на хемоглобина да свързва и освобождава кислород се отразявачрез крива на дисоциация на кислородТази крива характеризира процента на насищане на хемоглобина с кислород в зависимост от неговия волтаж (Ро2).
Когато кръвта преминава през тъканите и освобождава 02, тя едновременно абсорбира крайния продукт от окислителните метаболитни процеси в клетките— CO2. Реакцията на свързване на хемоглобина сCO2.е по-сложна от добавянето на 02. Това се дължи главно на ролята на CO2 в създаването на киселинно-алкален баланс в тялото. Механизмите, които осигуряват транспортирането на газ, също са предназначени да поддържат този баланс. Хемоглобинът, свързан с CO2, се наричакарбохемоглобин.
Хемоглобинът е особено лесен за свързване с въглероден оксид - въглероден оксид - CO.carboxyhemoglobin(HbCO) is formed, which is not capable of transferring02.In this case, the patterns of its reaction are the same as for oxygen, but the chemical affinity of CO for hemoglobin is almost 300 times higher than for 02. This means that it is enough to be in the air a small amount of CO for the formation of a significant number of bound hemoglobin molecules to occur. Полученото съединение - хемоглобин, блокиран от въглероден окис - вече не може да служи като носител на кислород. И така, при концентрация на CO във въздуха, равна на 0,1%, около 80% от кръвния хемоглобин се свързва не с кислород, а с въглероден окис. В резултат на това в организма възникват тежки последициот кислородния глад(повръщане,
главоболие, загуба на съзнание).
Хемоглобинът, поставен в контакт със силни окислители (калиев перманганат, бертолетова сол, нитробензен, анилин), образува съединениетометхемоглобин(NHOH), което има кафяв цвят. В този случай настъпва окисление на желязото и преминаването му в тривалентна форма. В резултат на истинското окисление хемоглобинът здраво задържа кислорода и в крайна сметка престава да бъде негов носител. Принаследствена метхемоглобинемиявъзниква дисбаланс между процесите на окисляване на хемоглобина и метхемоглобина и възстановяването на хемоглобина. Проявява се през първата година от живота като синкав цвят.кожа (цианоза) и повишени нива на метхемоглобин в кръвта
Миоглобин.В скелетните и сърдечните мускули на животни от различни класове и групи има мускулен хемоглобин -миоглобин(Таблица 7.3). Това е червен пигмент за дъх. По своите биохимични характеристики миоглобинът е близък до кръвния хемоглобин. Сходството се изразява в наличието на една и съща простетична група, същото количество желязо в способността да влиза в обратими съединения с O2 и CO 2. Свързващите кислород свойства на миоглобина обаче се различават значително от тези на хемоглобина. Поради по-ниската му плътност от тази на хемоглобина, афинитетът му към кислорода рязко нараства. Следователно миоглобинът е изключително адаптиран към отлагането на O2. Това е от голямо значение за снабдяването на мускулите с кислород, особено тези, които произвеждат ритмични контракции за дълги периоди от време: мускулите на крилете на птиците, мускулите на крайниците на топлокръвните животни, дъвкателните мускули, сърдечния мускул. С активността на всички тези мускули във фазата на свиване, капилярите се притискат, така че кръвотокът през тъканта в тази фаза всъщност спира. Точно в този момент миоглобинът служи като важен източник на кислород, тъй като той "съхранява" O2 по време на релаксация и го освобождава по време на мускулна контракция. Поради високия афинитет към кислорода, полунасищането на миоглобина с него става при нормални условия по-бързо от 0,1 s.
Сърцето на топлокръвно животно съдържа около 0,5% миоглобин. Когато напрежението падне O 2 от 40 до 5 mm Hg. Изкуство. това количество освобождава 2 ml O 2 за всеки 1 g сърдечна мускулна тъкан. Този обем газ е достатъчен, за да покрие кислородните нужди на сърцето по време на систола.
Съдържанието на миоглобин в сърдечните и скелетните мускули на някои класове гръбначни животниживотни, g на 100 g суха тъкан