Кулонометричен анализ
Кулонометрията се основава на законите на Фарадей, установявайки връзка между количеството електричество, преминало през разтвора на електролита, и масата на веществото, освободено на електрода в резултат на електрохимична реакция.
В зависимост от електрохимичните процеси, протичащи в разтвора, се разграничават директна кулонометрия и кулонометрично титруване. В първия случай се определя електрохимично активно вещество, което се отлага (или преминава в ново състояние на окисление) върху електрода при даден потенциал на електролиза, докато количеството консумирана електроенергия е пропорционално на количеството на реагиралото вещество. Във втория случай в анализирания разтвор се въвежда електрохимично активен спомагателен реагент, който количествено химически взаимодейства с аналита. Съдържанието на компонента, който трябва да се определи, се оценява от количеството електричество, преминало през разтвора до края на химическата реакция, което се определя, например, с помощта на цветни индикатори. Директната кулонометрия от своя страна се подразделя на потенциостатична кулонометрия и амперостатична кулонометрия. В първия случай анализът се извършва при поддържане на постоянна стойност на потенциала на работния електрод, във втория - при постоянен ток.
Потенциостатична кулонометрия. Всеки йон, участващ в електрохимична реакция, ще бъде освободен от електрода само ако бъде достигнат неговият разряден потенциал. На фиг. е представена кривата ток-напрежение за многокомпонентна система. При стойността на електродния потенциал1започва разреждането на един от компонентите на разтвора, потенциалът2съответства на началото на разряда на втория компонент. При потенциал 3, третияткомпонент. По този начин, чрез задаване на една или друга стойност на потенциала на електрода, е възможно да се гарантира, че определен йон се освобождава върху работния електрод.
Потенциостатичната кулонометрия се основава на измерване на количеството електричество, използвано за електрохимична редукция или окисление на аналита при постоянна стойност на потенциала на работния електрод. За да може процесът да протича с максимална скорост и 100% токова ефективност, електролизата трябва да се извърши при потенциал, съответстващ на средата на зоната на ограничаващия дифузионен ток на аналита. За първия компонент този потенциал съответства на1’.
Ориз. Крива ток-напрежение на многокомпонентна система
Тъй като определяният йон се редуцира или окислява върху електродите, концентрацията му в разтвора намалява и токът във веригата пада. Общото количество електроенергия, изразходвано за пълната електрохимична трансформация на определяния йон, се изразява с площта, ограничена от кривата в координатите "сила на тока - време" (фиг. а) и се изчислява по формулата
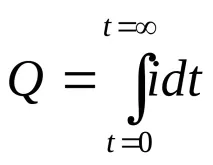
Ориз. Зависимост на силата на тока от времето на електролизата: а) - теоретична крива ток-време при потенциостатични условия; б) - кинетична крива при потенциостатични условия; в) - кинетична крива в полулогаритмични координати
За пълна електрохимична трансформация на дадено вещество е необходимо безкрайно дълго време, т.кi0приt. Следователно, за практически цели, големината на тока по всяко време може да се определи от уравнението
къдетоitе текущата стойност към моментаt, A;i0- ток в началото на електролизата, A;k-константа в зависимост от условията на електролиза, s -1. В съответствие с уравнение (1), намаляването на тока вървипо експоненциалната крива (фиг. b).
Като вземем логаритъм на уравнение (1), получаваме:
Полученият израз е права линия, пресечната точка на която с оста y съответства наlni0, а тангенса на нейния наклон еk. След като се определи стойносттаk, количеството електричество се намира по формулата
Съдържанието на анализираното вещество се определя по закона на Фарадей.
Предимството на потенциостатичната кулонометрия е високата селективност на метода; възможността за последователно определяне на веществата в тяхната смес.
Амперостатична кулонометрия. Основава се на определяне на количеството електричество, изразходвано за електрохимичните трансформации на аналита при постоянна стойност на тока, протичащ през електролитната клетка. Тъй като определянето на веществото, съдържащо се в разтвора, с този метод се извършва при постоянна стойност на силата на тока, като се определи времето за електролиза, е възможно да се изчисли количеството електричество по формулата
В практиката на анализа обаче има трудности. По време на електролизата, тъй като концентрацията на аналита намалява, потенциалът на работния електрод се променя и става възможно да се освободи друг компонент от разтвора. Следователно ще има разходи за електроенергия за странични електрохимични процеси (текущата ефективност за аналита ще бъде по-малка от 100%). За да се избегне това, се вземат специални мерки. Например, в тестовия разтвор се въвежда спомагателен реагент, който участва в електрохимична реакция и продуктът от тази реакция трябва да взаимодейства стехиометрично с определяното вещество.
От законите на Фарадей следва, че количеството електричество, преминало през електролитен разтвор, може да се определи от масата на продуктитеелектролиза, освободена върху електрода по време на преминаването на ток. Кулометър се използва за определяне на количеството електричество, протичащо през електролитен разтвор.
Кулометъре електрохимична клетка, в която протича добре проучена реакция със 100% токова ефективност. Принципът на действие на кулометъра се основава на факта, че той е включен в електрическа верига последователно с електрохимична клетка, в която се излива анализираният разтвор. Така за определен период от време едно и също количество електричество ще премине през анализирания разтвор и през кулометъра. Тъй като в кулометъра протича добре известна електрохимична реакция (например Cu 2+ + 2e - Cu 0), измерването на количеството електричество се свежда до определяне на масата на веществото, освободено на катода на кулометъра, и изчисляване по формулата:
В зависимост от метода на измерване се разграничават електрогравиметрични, титрационни и електронни кулометри. В електрогравиметричните кулометри се определя масата на веществото, отделено върху електрода. Електронен кулометър директно отчита броя на кулони.
Кулонометрията се използва за определяне както на следи (на ниво 10 -9 -10 -8 mol/l), така и на много големи количества вещества с висока точност. Много неорганични (практически всички метали, включително тежки метали, халогени, S, NO3 - , NO2 - ) и ароматни вещества (ароматни амини, нитро- и нитрозо съединения, феноли) могат да бъдат определени кулонометрично.