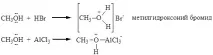
Лабораторни методи за получаване на алкохоли
1. Хидролизата на халоалкани във водни разтвори на основи протича по механизма на нуклеофилно заместване (виж лекция № 12)
Алкен хидратация
Добавянето на вода към алкена протича в присъствието на киселинни катализатори (H2SO4, H3PO4, двуалуминиев оксид и други третирани с киселина носители).
Този метод произвежда нисши алкохоли в голям мащаб, от които етанолът е най-важният продукт:
от пропилен иn-бутилен - изопропилов иn-бутилов алкохол:
и от изобутилен -tert-бутилов алкохол:
Електрофилният механизъм на хидратация вече беше разгледан по-рано. Добавянето протича съгласно правилото на Марковников, реактивността на алкените се определя от сравнителната стабилност на получените карбокатиони и промени в серията:
3. Възстановяване на карбонилни съединения (кетони и алдехиди), естери
Алдехидите и кетоните лесно се редуцират от водород в присъствието на катализатори (например Ni, Pd, Pt) до съответните първични и вторични алкохоли:
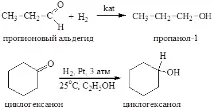
За намаляване на карбонилната група широко се използват и сложни метални хидриди - натриев борохидрид NaBH4 (разтворител - вода, етанол) или литиево-алуминиев хидрид LiAlH4 (разтворител - абсолютен етер). Карбонилните съединения могат също да бъдат редуцирани с атомен водород, образуван при взаимодействието на метален натрий с етанол.
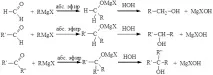
Синтези на алкохоли с използване на реактиви на Гринярд
При взаимодействието на реактиви на Гриняр (RMgHal) и органолитиеви съединения с карбонилни производни се образуват метални алкохолати, които под действието на вода или разредена киселина могат да се превърнат в съответните алкохоли. Реакция на реактивите на Гринярд сформалдехид, други алдехиди и кетони е отличен начин за получаване на първични, вторични и третични алкохоли:
Промишлени методи за получаване на алкохоли
1. Окисляване на алкани (синтез на С10-С20 алкохоли). Алкохолите с нормална структура C10-C20 представляват интерес като суровини за синтеза на повърхностноактивни вещества. Производството на тези алкохоли чрез окисляване на парафин съгласно метода на A.N. Башкиров е разработен и внедрен за първи път в СССР. Окисляването се извършва с атмосферен кислород в присъствието на 4-5% борна киселина, която свързва получените алкохоли в естери, които не подлежат на по-нататъшно окисление:
Получените алкохоли, които се образуват без разрушаване на въглеродната верига, са предимно вторични, с примес на гликоли и кетоалкохоли.
Тази фракция като суровина за повърхностно активни вещества е с малка стойност и методът не е широко използван.
2. Синтез на алкохоли по метода на Фишер-Тропш2. При високо налягане CO и H2 образуват смес от кислородсъдържащи съединения (синтол) - алкохоли, алдехиди, кетони, карбоксилни киселини и естери. Този метод намери широко приложение за синтеза на метанол:
3. Процесът на оксосинтеза. Реакцията е открита от Relin през 1938 г. Целта на процеса е производството на алдехиди от алкени и синтезен газ (CO + H2) и тяхното хидрогениране до алкохоли:
Първичните алкохоли С10-С18 с линейна структура са суровини за производството на повърхностноактивни вещества като алкилсулфати, които имат висок индекс на биоразградимост, алкохолите С7-С9 служат като междинни продукти за производството на естерни пластификатори, особено фталати.
4. Ензимна хидролиза на въглехидрати от бактериите Clostridium acetobutilicum. Този метод произвеждаn-бутанол, смесен с ацетон.
Физическисвойства на алкохолите
Много физични и химични свойства на алкохолите, особено тези с ниско молекулно тегло (сравнително високи точки на кипене, значителна разтворимост във вода), се дължат на способността на хидроксилната група да образува междумолекулни водородни връзки.
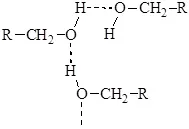
С удължаването на въглеводородната верига относителното влияние на водородните връзки намалява и едновалентните алкохоли с дълга въглеродна верига се доближават до съответните алкани по техните физични свойства. Така че само нисши алкохоли - метил, етил, изопропил и третичен бутил - могат да се смесват с вода във всяко съотношение и, например,n-хексанолът разтваря само 0,6% вода.
Точки на кипене на алкохоли
| Алкохол | Точка на кипене, °С |
| CH3OH | 64.5 |
| C2H5OH | 78.3 |
| 4n5-C3H7OH | 97.8 |
| 4n5-C4H9OH | 117.7 |
| 4n5-C10H21OH | 231,0 |
Нормалните алкохоли кипят по-високо от алкохолите с разклонена верига. С еднакъв брой въглеродни атоми първичните алкохоли кипят при по-висока температура от вторичните алкохоли, а вторичните алкохоли при по-висока температура от третичните. Точките на топене, напротив, са по-високи за третичните алкохоли. Плътността на алкохолите е по-малка от 1.
Химични свойства на алкохолите
В молекулата на алкохола има три реакционни центъра.
1) О-Н-връзка: има ясно изразена полярност поради високата електроотрицателност на кислорода в сравнение с водорода, реакциите с разкъсване на О-Н връзката определят киселинността на алкохола;
2) несподелената електронна двойка на кислородния атом определя основността и нуклеофилността на алкохола;
3) C-O-връзка:също има полярност поради разликата в електроотрицателността на кислорода и въглерода, разкъсването на С-О връзката е характерно за реакциите на нуклеофилно заместване и β-елиминиране
В съответствие с изброените реакционни центрове за алкохоли могат да се разграничат следните реакции:
2. Нуклеофилно заместване на хидроксилната група
3. Дехидратация на алкохоли
4. Окисляване на алкохоли.
1.Киселинни и основни свойства на алкохолите. Алкохолите могат да действат като киселини и като основи. Константата на дисоциация на етанолKa(pKa=10 -16 ) е 10 10 пъти по-висока отKaацетилен (pKa=10 -26 ).
Поради киселинните си свойства, алкохолите лесно взаимодействат с алкални метали, образувайки соли (алкохолати):
Киселинността на алкохолите се определя от структурата на алкилния радикал. И така, киселинността в серията от по-ниски алкохоли се променя, както следва:
tert-бутиловият алкохол има най-ниска киселинност, тъй като съответният алкоксиден анион е най-малко стабилен поради електронодонорния ефект на метиловите групи:
Основните свойства на алкохолите се проявяват във връзка с протонни и апротонни киселини. Донорът на електрони в молекулата на алкохола е кислородният атом: