Лекции №3 Основи на стереохимията - сборник от курсови работи, измамни листове, лекции, дипломи
1. Конформации (ротационен изомеризъм).
2. Геометрична изомерия.
3. Оптична изомерия (енантиомерия).
5. Методи за получаване на стереоизомери
1. Конформации (ротационен изомеризъм).
2. Геометрична изомерия.
3. Оптична изомерия (енантиомерия).
5. Методи за получаване на стереоизомери
Стереохимията е част от химията, посветена на изучаването на пространствената структура на молекулите и влиянието на тази структура върху физичните и химичните свойства на веществото, върху посоката и скоростта на техните реакции.
1. Конформации (ротационен изомеризъм)
Преходът от най-простия органичен въглеводород, метан, към неговия най-близък хомолог, етан, поставя проблеми на пространствената структура, за решаването на които не е достатъчно да се знаят параметрите, разгледани по-рано. Без да се променят нито ъглите на свързване, нито дължините на връзките, човек може да си представи множество геометрични форми на молекулата на етана, различаващи се една от друга във взаимното въртене на въглеродните тетраедри около връзката C-C, която ги свързва. В резултат на такова въртене възникватротационни изомери (конформери). Енергията на различните конформери не е еднаква, но енергийната бариера, разделяща различните ротационни изомери , е малка за повечето органични съединения. Следователно, при нормални условия, , като правило, е невъзможно да се фиксират молекули в една строго определена конформация. Обикновено няколко въртящи се форми, които лесно преминават една в друга, съжителстват в равновесие.
Разгледайте методите за графично представяне на конформациите и тяхната номенклатура. За молекулата на етана е възможно да се предвиди съществуването на две максимално различни енергийни конформации. Те са показани по-долу катопроекции в перспектива(1)("кози от дъскорезница"),странични проекции(2) иформули на Нюман(3).

В перспективна проекция (1a, 1b), C-C връзката трябва да си представим като отиваща в далечината; въглеродният атом, стоящ отляво, е близо до наблюдателя, стоящият отдясно е отстранен от него.
В страничната проекция (2а, 2b) четири Н-атома лежат в равнината на чертежа; въглеродните атоми всъщност са донякъде извън тази равнина, но обикновено се смята, че опростено лежат и в равнината на чертежа. "Мазните" клиновидни връзки чрез удебеляване на клина показват излизане от равнината в посока към наблюдателя на атома, към който е обърнато удебеляването. Пунктираните клиновидни връзки маркират разстоянието от наблюдателя.
В проекцията на Нюман (3a, 3b), молекулата се разглежда по дължината на C-C връзката (в посоката, посочена от стрелката във формули 1a,b). Три линии, отклоняващи се под ъгъл 120 o от центъра на кръга , означават връзките на въглеродния атом, който е най-близо до наблюдателя; линиите , "стърчащи" зад кръга, са връзките на отдалечения въглероден атом.
Конформацията, изобразена вляво, се наричаекранирана. Това име напомня за факта, че водородните атоми и на двете СН3 групи са един срещу друг. Екранираната конформация има повишена вътрешна енергия и следователно е неблагоприятна. Конформацията, показана вдясно, се наричазатруднена, което означава, че свободното въртене около C-C връзката е „забавено“ в тази позиция, т.е. молекулата съществува предимно в от тази конформация.
Минималната енергия, необходима за пълно въртене на молекула около определена връзка, се наричабариерно въртенеза тази връзка. Ротационната бариера в молекула като етан може да бъде изразена като промяна в потенциалната енергия на молекулатакато функция на промяна надиедрален (усукващ) ъгълна системата. Двустенният ъгъл (означен с t ) е изобразен на фигурата по-долу:
Енергийният профил на въртене около C-C връзката в етан е показан на следващата фигура 7.1. Въртенето на "задния" въглероден атом е изобразено чрез промяна на двустенния ъгъл между двата показани водородни атома. За простота, останалите водородни атоми са пропуснати. Ротационната бариера, разделяща двете форми на етана, е само 3 kcal/mol (12,6 kJ/mol). Минимумите на кривата на потенциалната енергия съответстват на затруднени конформации, максимумите - закрити. Тъй като при стайна температура енергията на някои сблъсъци на молекули може да достигне 20 kcal/mol (около 80 kJ/mol), тази бариера от 12,6 kJ/mol лесно се преодолява и въртенето в етан се счита за свободно.
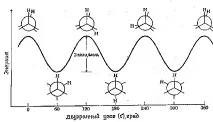
Фиг.7.1. Диаграма на потенциалната енергия на етановите конформации.
Всяка точка от кривата на потенциалната енергия съответства на определена конформация. Точките, съответстващи на минимумите, съответстват на конформационни изомери, тоестпреобладаващите компоненти в сместа от всички възможни конформации.
Тъй като молекулата става по-сложна, броят на възможните конформации се увеличава. И така, заn-бутан вече е възможно да се изобразят шест конформации, които се различават по взаимното разположение на СН 3 групите, т.е. завъртане около централната C-C връзка. По-долу конформациите на n-бутан са показани като проекции на Нюман. (екранираните) конформации, изобразени вляво, са енергийно неблагоприятни; само възпрепятстваните се реализират на практика.

Различните затъмнени и затруднени конформации на бутан не са идентични по енергия. Съответните енергии на всички конформации,образувани по време на въртене около централната C-C връзка, са показани на фиг. 7.2.

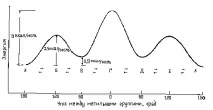
Фиг. 7.2. Диаграма на потенциалната енергия на n-бутанови конформации.
И така, конформациите са различни пространствени форми на молекула, която има определена конфигурация. Конформерите са стереоизомерни структури , съответстващи на енергийните минимуми на диаграмата на потенциалната енергия, в подвижно равновесие и способни на взаимно преобразуване чрез въртене около прости връзки.
Понякога бариерата на такива трансформации става достатъчно висока за разделяне на стереоизомерни форми (например, оптично активни бифенили). В такива случаи те вече не говорят за конформери, а за наистина съществуващистереоизомери.
2. Геометрична изомерия
Важно следствие от твърдостта на двойната връзка (отсъствието на ротация около нея) е съществуването нагеометрични изомери. Най-често срещаните от тях сацис-, транс-изомерина съединения от етиленовата серия, съдържащи неравни заместители при ненаситени атоми. Най-простият пример са бутен-2 изомерите.