Механизъм на хидратация на циментовите съставки
Трикалциеви и дикалциеви силикати.
Механизмът на хидратация на отделните съставки на цимента и самият цимент е обект на значителни дискусии и спорове. В ранната си теория Льо Шателие представя хидратацията на цимента чрез разтваряне на безводни съединения, последвано от кохезия и утаяване на кристали от хидратираните съединения. Михаелис смята, че кохезията е резултат от образуването и последващото изсъхване на гела. Наскоро беше разработена идеята за топохимичен или твърдофазов механизъм. Въпреки големия брой работи в тази област, разбирането на механизма на хидратация на C3S, основната фаза на цимента, все още остава неясно. За да се обясни, се предлага да се вземат предвид някои от етапите, през които преминава процесът на хидратация. Могат да се отбележат пет етапа на термокинетичната крива на калориметрията при изотермични условия (фиг. 1).
На първия етап, веднага щом C3S влезе в контакт с вода, първо има скок в скоростта на отделяне на топлина и след това нейното намаляване за 15-20 минути. Този етап се нарича период преди индукция. Във втория етап скоростта на реакцията е много ниска. Това е индукционният период. Може да продължи няколко часа.
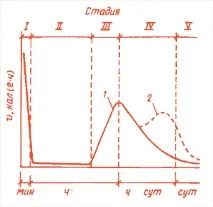
Ориз. Фиг. 1. Термокинетични криви (промяна в скоростта на отделяне на топлина v с времето) за процесите на хидратация на C3S (1) и портландцимент (2)
По това време циментовата паста запазва своята пластичност и обработваемост. Смята се, че първите две стъпки, които могат да бъдат повлияни от добавки, влияят на последващата хидратация на C3S. На третия етап реакцията протича активно, със самоускоряване, достигайки максимална скорост в края на този етап. Времето, съответстващо на началото на втвърдяването, приблизително съвпадас времето, когато скоростта на реакцията започне силно да нараства, и времето до края на втвърдяването, с времето на завършване на третия етап. На четвъртия етап скоростта на отделяне на топлина от C3S постепенно намалява. Хидратацията на C3S продължава. На последния пети етап се образува само малко количество продукти на хидратация на C3S. Този етап се контролира от процеса на дифузия.
Най-голямо внимание се обръща на първите два етапа. Първо, веднага щом C3S влезе в контакт с вода, калциевите и хидроксилните йони преминават в разтвора. Във втория етап разтварянето на C3S продължава и pH се повишава до 12,5. Тук се образува малко количество силикати. След достигане на определена критична концентрация на калциеви и хидроксилни йони започва бърза хидратация на C3S с образуване на Ca(OH)2 и C-S-H (трети етап).
Много публикации са посветени на обяснението на механизма, който причинява индукционния период и неговия последващ край. Обикновено се смята, че първоначалните реакционни продукти се образуват на повърхността на C3S, което забавя по-нататъшната реакция. Възобновяването на реакцията се причинява от разрушаването на повърхностния филм. Първоначално хидратите имат високо съотношение C/S от около 3, след което то намалява до 0,8–1,5 чрез прехода на Ca йони в разтвор. Вторичните хидрати имат свойства, които позволяват на йони да проникват през тях, позволявайки протичането на бърза реакция. Трансформацията на първичните хидрати във вторични се случва, очевидно, поради процесите на тяхното зараждане и растеж на кристали. Въпреки че тази теория е в съответствие с много наблюдения, има други факти, които не я подкрепят. Например съотношението C/S на продуктите е по-ниско от посоченото, защитният филм не е достатъчно удължен, реакционният продукт е крехък филм, който лесно се отделя от повърхността и първоначалниятразтварянето може или не може да бъде конгруентно. Краят на индукционния период се обяснява с бавното образуване на CH ядра. Обикновено наблюдавахме бърз растеж на СН кристали и преход на Ca йони в разтвор в края на индукционния период. Това предполага, че отлагането на CH е свързано с началото на етапа на ускорение. Ако утаяването на CH дава тласък на реакцията, тогава добавянето на Ca-йони трябва да я ускори, ако ядрата не са отровени.
Както знаете, добавянето на вар забавя реакцията. Образуването на C-S-H също не обяснява периода на ускорение. В работата беше отбелязано, че зета потенциалът на хидратирания C3S е положителен; това може да показва възможността за хемосорбция на Ca йони върху получената C3S повърхност и филмът е бариера между C3S и водата. Смята се, че по време на утаяването на Ca(OH)2 Ca2+ преминава от разтвора (което от своя страна трябва да инициира отстраняването на Ca2+ от бариерата). В резултат на това реакцията на хидратация се ускорява.
Има и други идеи, на пръв поглед самостоятелни, но с много общи черти, в които се прави опит да се обяснят резултатите от наблюденията. Хидратацията на C2S протича по същия начин като C3S, но много по-бавно. Количеството топлина, отделено от C2S, е много по-ниско от C3S. Кривата на скоростта на отделяне на топлина няма толкова изразени пикове, както на фиг. 1. Ускорителите увеличават скоростта на реакцията C2SH2O. Взаимодействието с вода C2S е по-малко проучено от C3S.
Трикалциев алуминат (или C4AF) + гипс + вода.
Пикове се наблюдават и на изотермичната калориметрична крива на процеса на хидратация на смес от C3A и гипс (виж фиг. 1), но времето на появата и дължината им се различават от тези, дадени за C3S. Според общоприетото схващане, забавянето на хидратацията на C3A в присъствието на гипс се дължи на образуването на тънкикристали етрингит по повърхността му. Този плътен филм се разрушава в индукционния период и се формира отново през този период. Когато целият сулфат е свързан, етрингитът реагира с C3A, за да образува моносулфатната форма на хидросулфоалумината. Тази трансформация настъпва, когато циментът е хидратиран между 12-36 часа с един екзотермичен пик. Някои добавки могат да ускорят или забавят тази трансформация.
Портланд цимент.
Механизмът, описан по-горе за чистите циментови компоненти, е основата за изследване на хидратацията на портландцимента. Калориметричните криви на C3S и портландцимента са подобни, но портландциментът може да има трети пик поради образуването на моносулфоалуминатен хидрат (виж Фиг. 1). Ефектите на C3A и C4AF върху C3S и C2S хидратацията не са напълно проучени в детайли. Бяха представени модели на защитния слой, отчитащи възможността за взаимодействие. Въпреки че първоначалните стъпки на процеса не са ясни за C3S (в цимент), може да се предположи, че продуктите на хидратация на C3A се образуват както чрез разтвор, така и топохимично.