Молекулярна биология, цитогенетика, биологични референтни материали - всичко това вие
Синдром на преждевременно стареене
Синдром на прогерия на Hutchinson-Gilford (HGPS)
Генът LMNA кодира прекурсора на ламин А. HGPS възниква от мутация на един LMNA ген, кодиращ преламин A/C, което води до делеция на 50 аминокиселини в прекурсора на протеина ламинА, преламин А, който е структурен протеин на ядрената мембрана (фиг. 2, 3). В нормалните клетки генът LMNA се състои от 25 000 базови двойки, преламин А иРНК се състои от 12 екзона. Седмият екзон кодира сигнала за ядрена локализация (NLS), който е необходим за транспортирането на протеина от цитоплазмата към ядрото. Алтернативното място на снаждане на ламин А/ламин С е разположено в десетия екзон.Протеинът преламин А се състои от 664 аминокиселини и носи CAAX мотив (661-664) в С-края, в който С-цистеинът, А е остатък от обикновено алифатна аминокиселина, X може да бъде всеки остатък. Този мотив се намира и в ламини B1, B2 и много други клетъчни протеини. Мотивът CAAX задейства три последователни реакции на ензимна пост-транслационна модификация, водещи до зрял ламин А, структурен протеин на ядрената мембрана:1. Фарнезил трансфераза (FTase) добавя С15-фарнезил липид към цистеин тиоловата група в рамките на CCAX мотива.2. Следващите три аминокиселини (т.е. AAX) се отстраняват от протеинпренил специфична ендопротеаза. Разцепването на протеини се извършва от две ендопротеази на мембраната на ендоплазмения ретикулум, Zmpste24 и Rce13. Новообразувания фарнезилцистеин се метилира от специфичната за пренил протеин ендоплазмена ретикулум метилтрансфераза Icmt. След като бъдат направени модификации на CAAX мотива, преламин А (за разлика от други CAAX-съдържащи протеини) претърпява допълнителна модификация. Фрагмент от С-терминал 15аминокиселини (647-661) на протеина, заедно с метилирания фарнезилцистеин, се изрязва от Zmpste24 металопротеазата и се разгражда. Остатъкът е зрял ламин А (фиг. 4). Фарнезилирането на преламин А е важно за разпознаването на ядрената мембрана. Всяка от трите модификации на преламин А създава хидрофобност на С-края, осигурявайки връзката му с вътрешната ядрена мембрана, след което протеинът се разцепва.
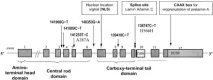
Фигура 2. Схема на структурата на гена LMNA
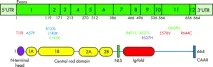
Фигура 3. Структурна диаграма на преламин А иРНК и протеин UTR - нетранслиран регион, NLS - сигнал за ядрена локализация, CAAX - пренилационен мотив. G608G, E145K и R471C, R527C са мутации, водещи до HGPS (показани в зелено).
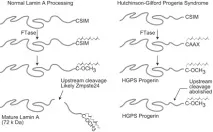
фигура 4.
Мутантен ламин. HGPS най-често възниква с точкови мутации в екзон 11 на LMNA, мутацията възниква при кодон 608 и активира криптично място на сплайсинг, което води до делеция на 50 аминокиселини в рамката за четене на преламин А (аминокиселини 606-656), но запазвайки С-терминалния CAAX мотив. В този случай се губи мястото, където преламинният протеин се разцепва по време на узряването. В нормалните клетки преламинът не може да бъде открит, тъй като незабавно се превръща в зрял ламин А. Мутантният преламин А, генериран от HGPS, наричан още прогерин, е домакин на CAAX мотив, който задейства фарнезилиране, но делеция на 50 аминокиселини предотвратява последващо обработване в зрял ламин А, което води до натрупване на прогерин в ядрената нуклеоплазма. Това води до нестабилност на мембраната: нейната цялост се нарушава, появяват се характерни издатини, увеличава се порьозността, което води до ускорена клетъчна смърт. В експерименти върху фибробластни клетъчни култури беше показано, че при липса на Zmpste24, количеството преламин Асе увеличиха и настъпиха промени, характерни за клетките на пациентите с прогерия - ядрата на фибробластите се деформират и съдържат множество мехури. Преламин А е токсичен и намаляването на нивото му до поне 50% осигурява защита срещу HGPS заболяване, което може да помогне при намирането на подход за лечение на този синдром.
Справка S.H. Янг, М.О. Берго, Дж.И. Тот, X. Qiao, Y. Hu, S. Sandoval, M. Meta, P. Bendale, M.H. Гелб, С.Г. Йънг, Л.Г. Фонг, блокираща протеинова фарнезилтрансфераза, подобрява ядреното бълбукане в миши фибробласти с насочена мутация на синдрома на Hutchinson-Gilford progeria. PNAS, 2005 г.
А.Б. Csoka, H. Cao, P. J. Sammak, D. Constantinescu, G. P. Schatten и R. A. Hegele Нови мутации на lamin A/C ген (LMNA) при атипични прогероидни синдроми Journal of Medical Genetics 2004; 41:304-308
пр.н.е. Капел, М.Р. Erdos, J.P. Madigan, J.J. Fiordalisi, R. Varga, K.N. Conneely, L.B. Гордън, C.J. Der, A.D. Кокс и Ф.С. Collins, Инхибирането на фарнезилирането на прогерин предотвратява характерното ядрено бълбукане на синдрома на Hutchinson-Gilford progeria PNAS, 2005, no. 36, 12879-12884.
Л.Г. Фонг, Дж.К. Нг, М. Мета, Н. Кот, С. Х. Янг, К. Л. Stewart, T. Sullivan, A. Burghardt, S. Majumdar, K. Reue, Martin O. Bergo и S.G. Младата хетерозиготност за дефицит на Lmna елиминира подобните на прогерия фенотипове в Zmpste24-дефицитни мишки PNAS, 2004, no. 52, 18111-18116.
Сувар20.10.05