Най-важните биолиганди
Бионеорганична химия
Задачите на бионеорганичната химия включват изучаването на структурата и биологичната роля на неорганичните съединения. Тези изследвания се извършват чрез различни физикохимични методи, както и методи на биологията и биохимията, включително математическо моделиране. Бионеорганичните изследвания са от първостепенно значение за решаване на проблемите на медицината, опазването на околната среда и неорганичните технологии. След това разглеждаме накратко свойствата и структурата на някои лиганди, които играят важна роля в биологията, по-специално съединения, които комплексират биометали, и след това пристъпваме към характеризиране на свойствата на най-важните бионеорганични съединения и тяхната роля в жизнените процеси на животни и растения.
2. Най-важните биолиганди
Биолигандите са молекули или йони, които взаимодействат с биометали в тялото. Много от тях се наричат "молекули на живота". Биолигандите са предимно органични съединения. Въпреки това, неорганичните лиганди, въпреки че са много по-малки, играят важна и незаменима роля в метаболитните процеси. Това са неорганични аниони, като халогенни йони (F-, C1-, I-), сулфатни и нитратни йони, както и хидроксилни, фосфатни и карбонатни йони, чието образуване и хидролиза допринасят значително за енергийната "касичка" на живия организъм. И накрая, това са неутралните молекули H2O, O2, CO2, NH3. Без тези лиганди метаболизмът, храненето и самият живот на организма са невъзможни.
Следователно изследването на взаимодействието със споменатите неорганични вещества на биометалните йони, както и на други катиони, които влизат в тялото отвън, е най-важната задача на биохимията. Взаимодействията, които възникват в биосистемите, не са специфични и се разглеждат в рамките на обикновените курсове по неорганична химия. Следователно, по-долу щеинформацията е представена само за лиганди, които са специфични за биосистеми или които моделират тези системи.
Комплекси с полидентатни и макроциклични лиганди
Основната характеристика на биолигандите е тяхната принадлежност към полидентатните и (много често) макроцикличните лиганди.
Както е известно, специфичната стабилност на комплексите, образувани от метални йони с полидентатни лиганди, се обяснява с образуването на един или повече хелатни цикъла от една молекула (или йон) на лиганда с даден централен йон (метален катион). Според правилото на Чугаев най-стабилни са петчленните хелатни пръстени (за системи без множествени връзки) и шестчленните пръстени (за системи със спрегнати двойни връзки). Спомнете си, че енергийното предимство на затварянето на хелатните цикли (хелатният ефект) се определя както от ентропийните, така и от енталпийните фактори. Да разгледаме като пример образуването на комплекс на Ni2+ с амоняк и етилендиамин en:
И в двата комплекса Ni2+ йонът координира два азотни атома. Голямата стойност на Kst в случая на етилендиаминовия комплекс несъмнено се свързва с хелатния ефект: комплексът [Niеn]2+ има петчленен хелатен пръстен, докато комплексът [Ni(NH3)2]2+ има „отворена” структура:
Координационно наситените Ni2+ амониати имат състав [Ni(NH3)4]2+ или [Ni(NH3)6]2+.
Установено е, че разликата в стойностите на константите на стабилност на тези два комплекса (A lgKst = 2.5) се определя от приноса на енталпията (∆H= - 1.9 kcal/mol) и ентропията (∆S = 6.2 cal/deg*mol). Разликата в енталпиите на образуване на тези съединения се обяснява с факта, че в случая на [Nien]2+, два азотни атома, влизащи в координационната сфера на Ni2+, не е необходимо да преодолеят взаимното отблъскване (за разлика от [Ni(NH3)2]2+). Азотните атоми на етилендиамина вече са включени в състава на една молекула („близо“ един до друг). Освен това при образуването на [Nien]2+ е необходима по-малко енергия за дехидратиране на лиганда, отколкото в случая на [Ni (NH3)2]2+: молекулите на амоняка са по-малки от en и са по-силно хидратирани.
Разликата в стойностите на ентропийните фактори по време на образуването на хелатни и "отворени" комплекси се дължи на увеличаване на броя на частиците по време на реакцията, докато по време на синтез във воден
в разтвор на никел (II) диамин броят на частиците не се променя в резултат на комплексообразуването:
което е свързано с бидентичността на en и моноидентичността на NH3.
Както отбелязва Yatsimirsky, в допълнение към хелатния ефект естествените метални комплекси, образувани от биолиганди, често имат макроцикличен ефект. Като пример се разглеждат термодинамичните характеристики на медни комплекси с лиганди L` и L" със същата плътност и подобна природа, но само в L" веригата е затворена в макроцикъл:
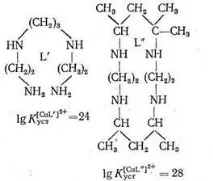
Както може да се види от горните данни, тетрадентатният лиганд L', който е макроцикъл, при равни други условия образува комплекс с Cu2+, който е 104 пъти по-стабилен от същия тетрадентатен лиганд L', който има структура с отворена верига. няма такава готова кухина и тя трябва да бъде създадена в процеса на комплексообразуване.
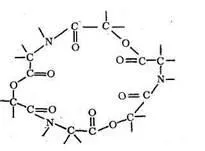
Един от най-простите естествени макроциклични лиганди е ениатинът, 18-членен хексадентатен лиганд, който включва киселинните остатъци на N-метил-валин и о-хидроксивалерат: