Нуклеозидите са
естествено гликозиди, молекулите на к-рих се състоят от остатъка от пуринова или пиримидинова основа, свързана чрез N атом с остатъка от D-рибоза или 2-дезокси-D-рибоза във формата на фураноза; в по-широк смисъл, n. и синтетичен. Comm., В молекулите to-rykh, хетероцикълът чрез N или C атом е свързан с всеки монозахарид, понякога силно модифициран (вижВторостепенни нуклеозиди)В зависимост от монозахаридните и хетероцикличните остатъци, включени в молекулата. основите разграничават рибо- и дезокси-рибонуклеозиди, пурин и пиримидин H.
Канонични Н. (виж фиг.) - аденозин (съкратено А), гуанозин (G), цитидин (С), техните 2'-дезоксианалози, както и тимидин (Т) и уридин (U) - са компоненти нануклеинови киселини.В природата Н. също се намират в свободна форма. състояние (предимно под формата нануклеозидни антибиотици).
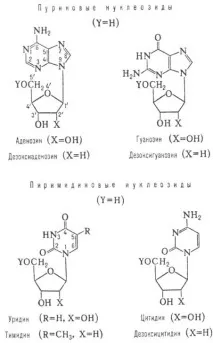
Основните нуклеозиди, които изграждат нуклеиновите киселини.
Основите в състава на Н. в кристал. състояние съответстват на тавтомерни форми, които са дадени в f-lah. Екзоцикличен групата NH2 е частично двойно свързана, което се проявява в скъсяването на CCHN връзката и липсата на свобода на въртене спрямо нея. В р-ре в незначителен. редица други тавтомерни форми също присъстват.
Базите и свързаните с тях атоми са практически копланарни. Дезоксирибозният пръстен в състава на N. винаги е неравнинен и обикновено е в С'2- или С'3-ендоконформация (съответно С атомът в позиция 2' или 3' е разположен над фуранозния пръстен). В p-re тези конформации са в динамика. баланс. Взаимната им трансформация възниква чрез O'4-ендоконформация; равновесното положение се определя от природата на заместителите при атомите в позиции С-2' и С-3'.
Всички естествени N. имат b-конфигурация на N-гликозидната връзка. Завъртанехетероцикличен основите по отношение на тази връзка са по принцип свободни, но комбинацията от редица стабилизиращи фактори води до предпочитанаанти-ориентация в случай на пиримидин N. (О-2 атомът е насочен далеч от захарта), докато пуринът N. се среща както вsyn-,, така и вanti-конформации (имидазоловият пръстен е насочен съответно към захарта и далеч от нея); изключение прави гуанозинът, за който е характернаsin-конформация.
Н.-кристален. in-va, имат характерни pH-зависими UV спектри (виж таблицата). Притежават слаби основни св-ти; тяхната разл. тенденцията към протониране (намалява в серията: C>G>A>T = U) се използва за разделяне на N. чрез йонообменна хроматография и електрофореза.
НЯКОИ ФИЗИЧНИ И ХИМИЧНИ СВОЙСТВА НА НАЙ-РАЗПРОСТРАНЕНИТЕ НУКЛЕОЗИДИ
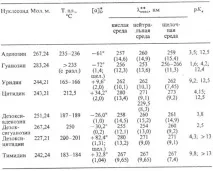
* Концентрацията на N. във вода, % отмаса е дадена в скоби; алкално-алкална среда. ** Стойността на e (в хиляди единици) е дадена в скоби.
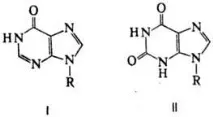
Chem. Saint-va N. се определят предимно от естеството на въглехидратните и хетероцикличните остатъци. Под действието на HNO2 настъпва дезаминиране, което води до екзоцикл. амино група в оксо- или енолна ф-ция (в резултат на тавтомерия); подобни трансформации. възникват под действието на нуклеозидни ензими т.нар. В същото време y r и d и n се образуват от цитидин, от аденозин-in o z и n, или r и box ox и n (f-la I, R-рибозен остатък; т.т. 218 ° C, [a] D 18 -49,2 ° при концентрация от 0,91% във вода; l max 248,5 nm, e 12200), от s и n a- ксантозин (форма II, R-рибозен остатък; т.т> 300 °C - разлагане, [a] D 30 -51,2 ° при концентрация от 1% в 0,1 N воден разтвор на NaOH; l max 253 nm, e 8790).
Трябва също да се отбележи ацилирането (включителнофосфорилиране) и алкилиране на монозахаридни остатъци от хидроксилни групи; N- и О-алкилиране чрез хетероцикличен. основи (предимно в позиции 3,4 на пиримидините и 6,7 на пурините); заместване на хидроксилите на монозахаридния остатък чрез разлагане. атоми и групи (H, Hal, NH2, N3 и др.); добавяне към 5,6-двойната връзка на пиримидините (хидрогениране, хидроксилиране, добавяне на бисулфит и други нуклеофили); халогениране (включително флуориране) и металиране (Ch. arr. получаване на Li-производни) на пиримидини в позиция 5 с последния. смяна на метал за дек. групи (предимно алкил); подобно халогениране с последния. заместване в позиция 8 на пурини; 5-хидроксиметилиране с последно. се превърна в CH 2 OH до карбоксил и неговата дериватизация; отваряне на пиримидиновия пръстен чрез действието на хидразин или хидроксиламин; образуването на N-оксиди, дестабилизиращи хетероцикличните. сърцевина; периодатно разцепване на 2',3'-гликоловата група на рибозния остатък с образуването на силно реактивен диалдехид; разцепване на N-гликозидната връзка, катализирано от to-tami (най-чувствителните са пурин N. от дезокси серията). Някои N. острови Св. се определят от комбинация от монозахаридни и хетероциклични остатъци. Да, вътре. нуклеоф. атаката на О атома в позиция 2 на пиримидина при С атома в позиция 2', 3' или 5' в присъствието на ефективна напускаща група (напр. тозил) води до съответните трициклични анхидронуклеозиди - важен междинен продукт. конн. в синтеза на аналози Н.
Естествените Н. получават прем. ензимна хидролиза на ДНК или алкална хидролиза на РНК с последната. ензимно дефосфорилиране на получената смес от нуклеотиди (нуклеозидни фосфати) и хроматографско. раздяла. Съществуващи ефективни методи на хим. използван синтез гл. обр. за получаване на неестествен Н., но постепенно, ставайки все повече и повечепо-икономични, те се прилагат за синтеза на естествен N. Обикновено синтезът на N. се извършва чрез взаимодействие. пертриметилсилил. основи с перацил. монозахарид или ацилхалогеноза (ОН гликозидната група е заменена с халоген, други ОН групи са ацилирани), съдържанието на основата е с перацетилир. монозахарид или кондензация на основата с ацилхалогеноза в присъствието. живачни соли. д-р пътят на синтез е завършването на хетероцикъл в състава на фрагмент, съдържащ рибоза, като се използва подходящ синтон (вижОрганичен синтез);този подход най-често се използва при синтеза на Н. с С-гликозидна връзка. Синтетично получени много N., модифицирани от основа и монозахарид (включително с линейна форма на последната вместо циклична), с a-конфигурация на N-гликозидната връзка и др.
Н. се използва като отправна точка в изкуствата. синтез на ДНК фрагменти (РНК) и нуклеотиден синтез, като лиганди в афинитетната хроматография, във вирусната химиотерапия, онкологията. и някои други заболявания (напр. 3-азидо-3'-деокситимидин или азидотимидин за синдром на придобита имунна недостатъчност, рибоксин за коронарна болест на сърцето, l-b-D-арабинофуранозилцитозин или цитарабин, противораково лекарство).
Справка:Органична химия на нуклеиновите киселини, М., 1970; Шабарова 3. А., Богданов А. А., Химия на нуклеиновите киселини и техните компоненти, М., 1978; Нуклеозидни аналози. Химия, биология и медицински приложения, изд. от R.T. Walker [a.o], N.Y.-L, 1979.Yu. А. Берлин.
Химическа енциклопедия. — М.: Съветска енциклопедия. Изд. И. Л. Кнунянц. 1988 г