Нуклиди, изотопи, масово число
Тъй като положителният заряд на протона и отрицателният заряд на електрона съвпадат по абсолютна стойност и са равни на елементарния заряд, в неутрален атом броят на електроните в обвивката винаги е равен на броя на протоните в ядрото. По този начин известният ядрен заряд определя броя на електроните в обвивката на неутрален атом. Химичните свойства на елементите зависят главно от броя на електроните, съдържащи се в най-отдалечената от ядрото обвивка, следователно общият заряд на атомното ядро е най-важният признак за индивидуалността на химичните елементи.
Всички атоми на един и същи елемент имат еднакъв ядрен заряд (броя на протоните в ядрото), а атомите на различни елементи имат различни ядрени заряди. Към днешна дата са известни 118 химични елемента, т.е. 118 атомни ядра с различен заряд. Всички известни елементи могат да бъдат подредени в един непрекъснат ред по реда на увеличаване на ядрения заряд на техните атоми. Числото, съответстващо на заряда на ядрото, се нарича пореден (атомен) номер на елемента (обозначение Z).
При преминаване от елемент към елемент (в последователността на увеличаване на техния пореден номер) броят на протоните, а оттам и зарядът на атомното ядро, се увеличава с единица, а броят на неутроните и следователно общият брой нуклони в ядрата на атомите на елементите нараства неравномерно.
Броят на нуклоните в ядрото на атома на даден елемент е равен на относителната атомна маса на елемента, закръглена до цяло число.
Водород Ar = 1.001; 1 нуклон
Въглерод Ar = 12.011; 12 нуклона.
Нуклиди, изотопи, масово число
Повечето от елементите, намиращи се в природата, са съставени от няколко вида атоми, които се различават по своите относителни атомни маси.
Пример.Хлорът се среща в природата като смес от два вида атоми, единият от които съдържа 18, а другият- 20 неутрона в ядрото.
Всеки тип атом (вид ядра) се наричануклид.Нуклидът е вид атоми и ядра, съответстващи на определен брой протони и неутрони.
Нуклидите, които принадлежат към един и същи елемент и се определят еднозначно от броя на протоните, но се различават по броя на неутроните, се наричат изотопни нуклидиили просто изотопи.
Изотопите на даден елемент са нуклиди, които имат еднакъв ядрен заряд (брой протони).Изотопите на даден елемент се различават само по броя на неутроните и следователно по общия брой на нуклоните.
Пример.Ядрата на два естествени изотопа на хлора съдържат по 17 протона, но 18 и 20 неутрона, т.е. 35 и 37 нуклона, съответно.
За нуклидите точните стойности на относителните атомни маси винаги са близки до целочислени стойности, така че масите на нуклидите могат да бъдат сравнени с тези стойности, нареченимасови числа.
Масовото число на нуклид е равно на броя на нуклоните, които съдържа (сумата от протони и неутрони).
Специална символика се използва за обозначаване на конкретен нуклид. Вляво от символа на химичен елемент горният индекс показва масовото число, а долният индекс показва заряда на ядрото (сериен номер на елемента). Например изотопът хлор-18 се записва като
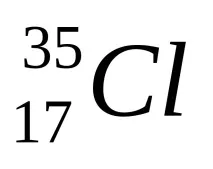
Масово число = Брой нуклони в ядрото.
Пореден номер = Броят на протоните в ядрото или броят на електроните в обвивката на атома.
Разлика между масовото число и серийния номер = Броят на неутроните в ядрото.