Стабилност и деградация на HMS разтвори
Стабилността и разрушаването на лиофилните колоидни разтвори, които включват разтвори на HMS в подходящи разтворители, се дължи на силното взаимодействие на дисперсната фаза с дисперсионната среда. Тъй като са термодинамично стабилни, такива системи не са склонни към спонтанно разрушаване и не изискват специален стабилизатор.
Разликата в стабилността и механизма на стабилизиране на лиофобните и лиофилните колоидни разтвори определя и различния механизъм на тяхното разрушаване. Коагулацията на лиофобни колоидни разтвори причинява намаляване на зета или междинния потенциал, когато се добавятмалки количества електролит.
За разрушаването на колоидни разтвори на повърхностноактивни вещества и HMS е необходимо достатъчноголямо количество електролит, тъй като той се изразходва за свързване на свободния разтворител и след това за взаимодействие със солватните обвивки на мицелите, т.е. със свързания разтворител.
Осоляване - обратимо разрушаване на лиофилната система, утаяване на разтворено вещество, причинено от добавянето на големи количества неутрални соли към разтвора.
Изсоляването възниква в резултат на нарушаване на солватната връзка между IMC макромолекулите и разтворителя, т.е. порадидесолватация на частици. Това води до постепенно намаляване на разтворимостта на ВМС и в крайна сметка до нейното утаяване. Изсоляващият ефект на електролита е толкова по-силен, колкото по-висока е степента на солватация на неговите йони, т.е. колкото по-висока е способността му да десолватира макромолекулите на HMW. Коагулацията на разтворите на IUD се причинява от двата йона на добавения електролит. Не само солите имат ефект на изсоляване, но и всички вещества, които могат да взаимодействат с разтворителя и да намалят разтворимостта на HMC. Например, желатинът е добре осолен от водни разтвори.ацетон и алкохол, тъй като те лесно се свързват с вода и по този начин дехидратират желатиновите частици.
Според действието на изсоляване, йоните са подредени в лиотропни серии (виж раздел 2.7).
Концентрацията на електролита, при която настъпва бързо утаяване на полимера, се наричапраг на изсоляванеHMC.Има пряка връзка между размера на водната обвивка на протеиновите молекули и концентрацията на сол: колкото по-малка е хидратационната обвивка, толкова по-малко соли са необходими.
Способността на спиралата да се "осолява" от разтворителя се увеличава с увеличаването на моларната маса на полимера. Това е основата за фракционирането на полидисперсни HMC по моларна маса, което се използва за разделяне на смес от протеини с различни моларни маси.
Изсоляването,като обратимо утаяване на протеини,включва утаяване на протеин под въздействието на определени вещества, след отстраняването на които той се връща в първоначалното си (нативно) състояние. За осоляване на протеини се използват соли на алкални и алкалоземни метали (най-често в практиката се използват натриев и амониев сулфат). Тези соли премахват водната обвивка (причиняват дехидратация) и премахват заряда от повърхността на макромолекулите.
Обикновено протеинът не губи способността си да се разтваря отново във вода след отстраняване на солите чрез диализа или гел хроматография. Осоляването на протеини обикновено се използва в клиничната практика при анализа на протеини в кръвен серум и други биологични течности, както и в препаративната ензимология за предварително утаяване и отстраняване на насипни протеини или изолиране на изследвания ензим. Различни протеини се изсоляват от разтвори с различни концентрации на неутрални разтвори на амониев сулфат. Поради това методът намери широко приложение в клиниката за разделяне на глобулини (утайка при 50%насищане) и албумин (отпадат при 100% насищане).
Степента на осоляване на протеините се влияе не само от природата и концентрацията на солта, но и от рН на средата и температурата, както и от йонната сила на разтвора.
По-фино разделяне на човешките плазмени протеини на фракции се постига с помощта на различни концентрации на етанол при ниски температури (от –3 до –5°C) съгласно метода на Kohn. При тези условия протеините запазват естествените си свойства. Този метод често се използва за получаване на отделни кръвни фракции, използвани като кръвозаместители.
Често утаяването на полимера се извършва чрез добавяне към разтвора на течност, в която той е по-малко разтворим ("утаител" или "неразтворител"). Колкото по-ниска е разтворимостта на HMC в даден разтворител, толкова по-бързо и по-пълно става изсоляването. За един и същи полимер разтворимостта зависи от дължината на макромолекулите. Колкото по-голяма е тяхната дължина и молекулно тегло, толкова по-ниска е разтворимостта и по-лесното изсоляване на частиците. Това свойство се използва при анализа наполидисперсни системи. Чрез постепенно добавяне на нарастващи количества от утаителя към разтвора, отделните фракции на частиците могат да бъдат изолирани от разтвора.
Изсоляването се използва в много технологични процеси (при производството на сапун, при изолирането на бои и колофон, при производството на изкуствени влакна).
Естествените протеини са надарени с определена, строго определена пространствена конфигурация и имат редица характерни физикохимични и биологични свойства при физиологични температури и стойности на pH. Под въздействието на различни физични и химични фактори протеините се коагулират и се утаяват, губейки естествените си свойства.
Денатурация - разрушаване на уникалната естествена (естествена) структура на протеинова молекула под външно въздействие.
По време на денатурацията се разрушават всички протеинови структури, главно неговата третична структура,с изключение на първичната. Денатурацията води до загуба на специфични за протеина свойства (разтворимост, електрофоретична подвижност, биологична активност и др.).
Повечето протеини се денатурират, когато техните разтвори се нагреят над 50–60°C. Денатурацията може да бъде причинена от концентрирани киселини и основи, танини, дехидратанти (ацетон, етанол, урея), ултравиолетово облъчване, рентгенови лъчи, промени в pH и йонната сила на разтвора.
Външните прояви на денатурация се свеждат до загуба на разтворимост, особено при IEP (pI), увеличаване на вискозитета на протеиновите разтвори, увеличаване на броя на свободните функционални SH-групи и промяна в естеството на разсейването на рентгеновите лъчи. Най-характерният признак на денатурация е рязко намаляване или пълна загуба от протеина на неговата биологична активност (каталитична, антигенна или хормонална). По време на денатурация на протеин, причинена от разтвор с концентрация на урея 8 mol/l или друг агент, се разрушават предимно нековалентни връзки, по-специално хидрофобни взаимодействия и водородни връзки. Дисулфидните мостове се разрушават в присъствието на редуциращия агент меркаптоетанол, докато пептидните връзки на гръбнака на самата полипептидна верига не се засягат. При тези условия глобулите от нативни протеинови молекули се разгръщат и се образуват произволни и неподредени структури (фиг. 60).
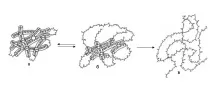
Ориз. 60.Денатурация на протеинова молекула (схема):
а - начално състояние; b - начало на обратимо нарушение на молекулярната структура; c - необратимо разгръщане на полипептидната верига
Протеинова денатурация се случва в стомаха, където има силно киселинна среда (pH 0,5 - 1,5), и това допринася заразграждане на протеини от протеолитични ензими. Отравянето с йони на тежки метали се основава на денатурация на ензимни протеини. В същото време денатурацията на протеини е основата за лечение на отравяне с тежки метали, когато пациентът приема per os („през устата“) мляко или сурови яйца, така че металните йони, денатуриращи млечните или яйчните протеини, се адсорбират на тяхната повърхност и не действат върху протеините на лигавицата на стомаха и червата и не се абсорбират в кръвта.
По време на процеса на готвене на храната се получава денатурация, което улеснява смилането й в храносмилателния тракт.
Едно от характерните свойства на HMS разтворите е тяхнотостареене, което се изразява в постепенна спонтанна промяна на вискозитета на разтворите при престояване. Стареенето се причинява от действието на кислород и примеси върху полимерните вериги. В резултат на това настъпва разрушаването на макромолекулите или тяхното агрегиране, т.е. загуба на стабилност.
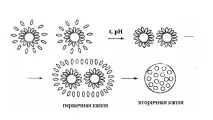
Ориз. 61. Схема на коацервация
Първоначално коацерватът е в първоначалния разтвор под формата на капки, след което се образува непрекъснат слой (възниква стратификация на системата). Процесът на коацервация се улеснява не само от висока концентрация на ВМС, но и от фактори, които причиняват спонтанна агрегация на мицели или макромолекули: въвеждане на електролити или неелектролити в разтвора, ниска температура, промени в рН на средата и излагане на различни полета. Действието на електролитите или неелектролитите е свързано с тяхната хидратация, коятоможе да възникне поради водни молекули в хидратационните обвивки на полимерите. В резултат на появата на "голи" фрагменти в макромолекулите се получава тяхното допълнително агрегиране. Коацервацията е процес на самоорганизация и структуриране на органични вещества във водната среда в самостоятелна фаза. Спонтанното образуване на коацервати в океаните е в основата на хипотезата на A.I. Опарин (1922) за произхода на живота.
Коацервацията се използва примикрокапсулиранена лекарства. За да направите това, лекарственото вещество се диспергира в полимерен разтвор и след това чрез промяна на температурата или рН на средата, изпаряване на част от разтворителя или въвеждане на изсоляващ агент, богата на полимер фаза се изолира от разтвора. Малки капки от тази фаза се отлагат върху повърхността на капсулованите частици, образувайки непрекъсната обвивка. Микрокапсулирането на лекарствата осигурява стабилност, удължава действието и маскира неприятния вкус на лекарствата. В научните изследвания микрокапсулите могат да се използват като модели на живи клетки.