Сулфонови киселини на фталоцианини
Сулфонови киселини на фталоцианини. Синтез, структура, свойства.
Това е един от най-важните класове органични пигменти. Фталоцианиновите пигменти са с високи бояджийски и технически свойства - ярък и наситен цвят, висока оцветяваща сила. Светлоустойчивостта им е толкова голяма, че дори когато се разреждат с бяло в много светли нюанси, те не се срутват при продължително излагане на светлина. Те са топлоустойчиви, устойчиви на действието на химически реагенти, включително окислители и редуциращи агенти. В страните, които са основните доставчици на органични пигменти, фталоцианиновите пигменти съставляват около 50% от производството на органични/пигменти. Фталоцианиновите пигменти образуват група от сини и зелени пигменти. Те са производни на фталоцианина, където централният водороден атом може да бъде заменен с метал. Причината за високата якост на фталоцианиновите пигменти е симетричната структура на молекулата. Една от най-често срещаните групи фталоцианинови багрила са сулфо-заместените фталоцианини.
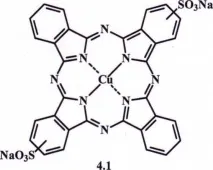
В момента сулфофталоцианините се използват като багрила, ефективни катализатори за различни редокс реакции, модели при изследване на някои биологични процеси, в медицината и др. Известно е, че натриевата сол на медния фталоцианин дисулфонова киселина - Direct Blue 86 - е първото промишлено произведено багрило на базата на фталоцианин.
Нека разгледаме по-подробно някои методи за получаване на сулфо-заместени фталоцианини.
1.Олеум сулфониране.Най-често използваният агент за директно сулфониране на Pc, по-специално CuPc, е олеумът. Този метод не е много добър, тъй като позволява само 1 или 2 сулфо групи да бъдат прикрепени към Pc без повишаване на налягането ипроцесът се провежда при достатъчно висока температура (100 - 120 гр. Целзий). По-нататъшното затягане на условията при получаването на три- и тетрасулфонови киселини се дължи на дезактивиращия ефект на въведените сулфо групи върху други бензенови пръстени на фталоцианин. Въпреки доста широко разпространения метод на директно сулфониране на Pc с олеум, той има редица съществени недостатъци: - образуването на съединения с различен брой и позиции на заместители, което често прави невъзможно изолирането на отделни вещества. - замърсяване на сулфонови киселини с продукти на разлагане, образувани при условия на високотемпературно сулфониране. - значителна част от сулфуриращия агент не се използва в реакцията и се губи безвъзвратно, което води до големи количества силно киселинни отпадъчни води при промишленото производство на такива вещества. - невъзможността за получаване на сулфо-заместени съединения, които са нестабилни в силно кисела среда.
2.Получаване на MPc сулфонови киселини от сулфонови хлориди
Сулфоновите киселини MPc могат да бъдат получени чрез хидролиза на съответните сулфонови хлориди. Следователно в този случай е препоръчително да се разглежда само производството на сулфохлориди. С оглед на факта, че сред сулфо-заместените MPc производни на CuPc се използват най-често, по-голямата част от данните се отнасят конкретно за този комплекс. С помощта на хлоросулфонова киселина в CuPc се въвеждат до четири заместителя, като реакционната температура играе решаваща роля. Така, в резултат на взаимодействието на CuPc с хлоросулфонова киселина при 100, 145 и 150 °C в продължение на 5 часа, се получават съответно ди-, три- и тетрасулфонови хлориди. Трисулфохлорид също се синтезира вече при 120-124 ° C, тетрасулфохлорид - при 134-140 ° C.2,5 до 6 часа.
3.Сулфатиране със серен анхидрид.През 70-те години на ХХ век се появява информация за използването на серен анхидрид при сулфонирането на Rs. Въпреки че сулфонирането със серен анхидрид със сигурност има някои недостатъци, предимствата на този метод, основните от които са възможността за създаване на процеси без отпадъци и сулфонирането на съединения, които са нестабилни в силно киселинни среди, ги припокриват. Кирин и Москалев сулфонират металофталоцианини с пари на серен анхидрид в среда от инертен газ. Японски учени сулфонират CuPc в адукт на серен анхидрид-пиридин при 220°C в продължение на 3,5 часа и получават смес от три- и тетрасулфонови киселини.В някои работи се дават примери за сулфониране на незаместени метални фталоцианини 4.2, тетра-3-4.3 и тетра-4-заместени кобалтови фталоцианини 4.4 с газообразен серен анхидрид. Във всички случаи на сулфониране по този метод се получават дисулфонови киселини.
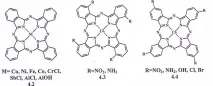
3.Метод на Wyler.Чрез взаимодействие на сулфофталова и фталова киселина или техни производни и соли на съответните метали в присъствието на урея и катализатор (борна киселина, амониев молибдат, смес от титанов тетрахлорид и йод, както и други съединения) в стопилка или във висококипящи органични разтворители (нитробензен, полихлоробензен). и др.), моно-, ди-, три- и тетрасулфофталоцианини (в зависимост от съотношението на сулфофталовата и фталовата киселина).
Този метод е широко разпространен, много удобен, икономичен и дава възможност за получаване на сулфонови киселини от различни MP и следователно често се използва в лабораторната практика; обаче в нашата страна производството на 4-сулфофталова киселина не е установено в промишлен мащаб, чието получаване е свързано с някои трудности при нейното изолиране и пречистване.
По подобен начин, т.е. По метода "карбамид" е синтезиран и кобалтов окта-3,5-сулфофталоцианин 4.9
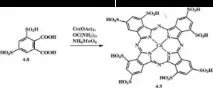
Като сол се използва безводен кобалтов ацетат. Комплекс 4.9 се пречиства от примеси чрез промиване с 80% воден разтвор на оцетна киселина до безцветни филтрати, изсушава се при 90–100 ° C до изчезване на миризмата на оцетна киселина, след което се екстрахира с вода, водният екстракт се изпарява и сухият остатък се промива с метанол. Фталоцианин 4.9 е тъмно синьо прахообразно вещество, силно разтворимо във вода и водни разтвори на основи, ограничено в DMF и други полярни органични разтворители, неразтворимо в органични разтворители с ниска полярност.
Първоначалната 3,5-дисулфофталова киселина 4.8 за синтез се получава както следва. Съединение 4.11 се синтезира чрез окисляване на дикалиева сол на 2-нафтол-6,8-дисулфонова киселина 4.10 с калиев перманганат (KMnO4) във водна алкална среда (Схема 4.2).
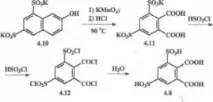
След края на окислението, съединение 4.11 се утаява чрез подкисляване със солна киселина до рН 3–4 и се охлажда. В този случай заедно с това съединение се отлагат неорганични примеси. По-чиста сол 4.11 се получава чрез утаяване на примеси от смес вода-етанол, 2:2,5, и по-нататъшно изолиране на 4.11 от филтрата.
За да се получи киселина 4.8, съединение 4.11 се превръща под действието на хлорсулфонова киселина в киселинен хлорид 4.12, който се екстрахира с ацетон. След отстраняване на ацетона, към сухия остатък се добавя вода, докато 4.12 се превръща в 3.5-дисулфофталова киселина 4.8.
Съединение 4.8 е прахообразно вещество със светложълт цвят, силно разтворимо във вода и водно-алкохолна среда.
4. Синтез от CuPc сулфати.Този метод е разработен от японски учени за получаване на моно- и дисулфонови киселини на меден фтоцианин. Така,Чрез нагряване на CuPc сулфат при 200 °C в продължение на 5 часа се изолира чиста моносулфонова киселина, докато нагряването на дисулфата на комплекса до 190–300 °C произвежда смес от дисулфонова и моносулфонова киселина. В същото време беше установено, че сулфогрупата влиза в четвъртата позиция на фениленовия пръстен на изоиндола.
5. Сулфониране със соли на сярна киселина. Този метод е описан само за получаване на дисулфонова киселина меден фталоцианин и се състои в нагряване на смес от фталонитрил, медна сол и хидрогенсулфат на алкален метал при 200 °C. Трябва да се отбележи, че нито CuPc, нито фталонитрилът като такива са сулфонирани с хидрогенсулфат на алкален метал.