Тема на урока Корозия на металите
1. Встъпителна реч на учителя 2. Корозия на метали 2.1 Методи за защита от корозия 2.2 Въздействието на корозията върху човешкото тяло и ролята на корозията в човешкото общество 3. Фиксиране 4. Обобщаване
Формирайте концепцията за корозия на метали, разгледайте класификацията на корозионните процеси, методите за защита на металите от корозия. Помислете за въздействието на корозията върху човешкото здраве. Помислете за екологичните проблеми, свързани с корозията на металите.
Оборудване: предварително подготвени (4-5 дни) проби -
епруветка No1 - разтвор на натриев хлорид + маслен пирон
епруветка № 2 - разтвор на натриев хлорид + горещ пирон, оплетен с медна тел.
епруветка No3 - разтвор на натриев хлорид + железен пирон + цинк
епруветка No4 - вода + горещ пирон
Вид на урока: изучаване на нов материал.
1. Встъпително слово на учителя
Учител: Темата, която ще разгледаме, е корозията на металите.
Трябва да разберем какво представлява корозията на металите? Какви са видовете корозия? Как протича този процес? Каква е ролята на корозията в живота на човешкото общество и защо да я изучаваме? Какви са начините за предпазване от него? Какъв ефект може да има корозията върху човешкото здраве?
Ще проведем урока с помощта на компютърни технологии. След като фиксираме материала, ще обобщим работата.
2. Корозия на металите
„Ръжта желязо яде“ е българска поговорка. Ръждата, която се появява на повърхността на продукти от стомана и чугун, е отличен пример за корозия.
Ръждясването се отнася само до корозията на желязото и неговите сплави. Други метали корозират, но не ръждясват.
И така, какво е корозия на металите?
Корозията на металите се нарича спонтаннапроцесът на разрушаване на метали и продукти от тях под въздействието на околната среда.
Корозията може да се класифицира:
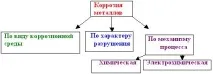
Непрекъснатата корозия се разпределя равномерно по цялата повърхност на метал или сплав (например процесът на ръждясване на железни сплави във въздуха или тяхното взаимодействие със силни киселини).
При локална корозия огнищата му са разпределени неравномерно - под формата на корозионни петна или точки, което е особено опасно за промишлено химическо оборудване.
Химическата корозия на металите е разрушаването на металите в резултат на химичното им взаимодействие с вещества от околната среда.
Най-разпространеният тип химическа корозия е газовата корозия, която възниква в сухи газове при пълна липса на влага. Газообразното вещество на околната среда реагира с метала на повърхността на металния продукт и образува съединения с него.
Електрохимичната корозия е разрушаване на метали, което е придружено от появата на електрически ток. Това е такава корозия, в резултат на която наред с химичните процеси (освобождаването на електрони от атомите на корозиралия метал - процесът на окисляване) възникват електрически процеси (прехвърляне на електрони от една част на продукта в друга).
Нека да разгледаме химическата корозия на металите във въздуха.
Как протича този процес? Помните ли какво е въздух?
Ученик:- Това е смес от газове, която има състав по обем:
Въглероден диоксид 0,031%
Благородни газове 0,935%, а останалото са примеси
Учител: Желязото постепенно се окислява под въздействието на O2, H2O и водородни йони. Този процес е редокс процес, при който металът е редуциращият агент. Корозията на желязото може да се опише с опростеното уравнение
Fe(OH) 3 ие ръжда.
Нека направим този експеримент
Взеха две епруветки, наляха вода в тях. Един от тях преварена вода. Поставени в двете епруветки върху почистен железен пирон. Колбите се затварят със запушалки. Къде процесът на корозия ще върви по-бързо?
Ученик:- Признаците на реакцията се появяват по-бързо в епруветка с непреварена вода.
Учителят: В този експеримент открихме ролята на атмосферния кислород в корозията на желязото. Нека заключим:
Извод: кислородът е един от неговите агресивни фактори.
Представете си следната инсталация: колба, в която са поставени железни стърготини, се затваря с коркова тапа с изходна тръба за газ, чийто край се спуска в чаша с оцветена вода, водата се издига през тръбата. Как можете да обясните този феномен?
Учителят: Ако кислородът е един от неговите агресивни фактори, тогава защо водата в алуминиев чайник кипи при нагряване, но не действа върху метала, а чайникът издържа доста дълго време?
Ученик:алуминияте много активен метал и теоретично трябва да взаимодейства с водата в съответствие с уравнението
Повърхността му обаче е покрита с плътен филм от оксид Al2O3, който предпазва метала от въздействието на водата и кислорода.
Учител: така че оксидният филм предпазва метала от въздействието на водата и кислорода.
Особено разнообразни процеси на химическа корозия се срещат в киселини, основи, соли, както и в разтопени соли и други вещества.
Големи проблеми са свързани с натриевия хлорид (в някои страни използват отпадъчен продукт - калциев хлорид), разпръснат през зимата по пътищата и тротоарите за отстраняване на сняг и лед. При наличие на соли те се стопяват, а получените разтвори се оттичат в канализационните тръби. Солите и особено хлоридите са активаторикорозия и водят до ускорено разрушаване на метали, по-специално превозни средства и подземни съоръжения.
Основната връзка за разбиране на електрохимичните процеси е редът на напрежението на металите. Металите могат да бъдат подредени в ред, който започва с реактивни и завършва с най-слабо реактивните благородни метали:
ОБХВАТ НА НАПРЕЖЕНИЕ НА МЕТАЛИ
Li, Rb, K, Ba, Sr, Ca, Mg, Al, Be, Mn, Zn, Cr, Ga, Fe, Cd, Tl, Co, Ni, Sn, Pb, H, Sb, Bi, As, Cu, Hg, Ag, Pd, Pt, Au.
Нека разгледаме ефекта на различни електролити върху процеса на корозия на металите.
В епруветка № 1 - разтвор на натриев хлорид + маслен пирон
В епруветка № 2 - разтвор на натриев хлорид + твърд пирон, оплетен с медна тел.
В епруветка № 3 - разтвор на натриев хлорид + железен пирон + цинк
В епруветка № 4 - вода + горещ пирон
Резултати от експерименти 1 и 2. И в двата случая желязото беше в един и същи разтвор, но в единия случай беше в контакт с мед, а в другия не. Тук-там се появи корозия и се появи кафяв налеп от ръжда. Но в експеримент 1 имаше малко ръжда, а в експеримент 2 имаше много. Резултатите от експерименти 1 и 3 и в двата случая желязото е в един и същ разтвор, но в единия случай е в контакт с цинк, а в другия не. Наблюдава се силна корозия, но в експеримент 2 кафявата утайка е ръжда, а в експеримент 3 бялата утайка е цинков хидроксид. Следователно в експеримент 3 не желязото е корозирало, а цинкът. По този начин желязото практически не корозира, ако влезе в контакт с цинк. Нека сравним резултатите от експерименти 1 и 4.
Ученик: Добавянето на натриев хлорид към водата увеличава корозията на метала.
Учителят: Видяхме, че корозията е универсално явление не само за желязото, но и за всички метали. Помислете за работата на галванична клетка.
Същността на работата на галваничния елемент
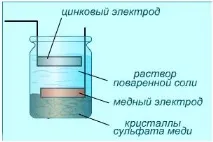
Първо напълнете чаша с вместимост 250 ml до средата с 10% разтвор на сярна киселина и потопете в нея не много малки парченца цинк и мед. Прикрепяме медна жица към двата електрода, чиито краища не трябва да докосват разтвора.
Докато краищата на жицата не са свързани един с друг, ще наблюдаваме разтварянето на цинка, което е придружено от отделяне на водород. Цинкът, както следва от серията на напрежение, е по-активен от водорода, така че металът може да измести водорода от йонното състояние. И двата метала образуват двоен електрически слой. Потенциалната разлика между електродите се открива най-лесно с волтметър. Веднага след включване на устройството във веригата стрелката ще покаже приблизително 1 V, но след това напрежението бързо ще падне.
Нека разгледаме по-подробно процесите в медно-цинковия елемент. На катода цинкът преминава в разтвор съгласно следното уравнение:
Водородните йони на сярната киселина се разреждат върху медния анод. Те прикрепят електрони, идващи през жицата от цинковия катод, и в резултат на това се образуват водородни мехурчета:
След кратък период от време медта ще бъде покрита с тънък слой водородни мехурчета. В този случай медният електрод ще се превърне във водороден електрод и потенциалната разлика ще намалее. Този процес се нарича поляризация на електрода. В практиката се използват галванични вериги, чиито електроди не са поляризирани, или вериги, чиято поляризация може да се елиминира чрез добавяне на деполяризатори.
Учителят: Сега нека поговорим за начините за защита на металите от корозия.
2.1 Методи за защита от корозия
1.легиране на метали, т.е. получаване на сплави. Например, голям брой неръждаеми стомани вече са създадени чрез добавяне на никел към желязото,хром, кобалт и др. Такива стомани наистина не ръждясват
2.нанасяне на защитни филмивърху повърхността на метали: лак, боя, емайл, други метали.
Поцинкованата ламарина се нарича галванизирано желязо, а покритата с калай се нарича тенекия. Първият се използва в големи количества на покривите на къщите, а от втория се правят тенекии. И двете се получават главно чрез издърпване на лист желязо през стопилка на съответния метал.
Покритията от цинк и калай (както и други метали) предпазват желязото от корозия, като същевременно поддържат непрекъснатост. Ако слоят на покритието е счупен (пукнатини, драскотини), корозията на продукта протича още по-интензивно, отколкото без покритие. Това се дължи на "работата" на галваничния елемент желязо - цинк и желязо - калай.
3. въвеждане на инхибитори (инхибитори на корозия)
Провеждане на експеримент. В епруветка се налива разредена сярна киселина до 1/5 от обема, след което в нея се поставят железни стружки. Довежда се до кипене. Наблюдава се отделянето на мехурчета водороден газ.
След това в същата епруветка се добавя инхибиторът на уротропина (1 натрошена таблетка). Уротропинът може да бъде заменен с тиокарбамид или сухо гориво. Реакцията с киселината е спряна.
4. Защитен метод за защита от корозия
Цинкът електрохимично защитава желязото от корозия. На този принцип се основава защитният метод за защита от корозия на метални конструкции и апарати. Английската дума "pretekt" означава защита, защита
2.2 Въздействието на корозията върху човешкото тяло и ролята на корозията в живота на човешкото общество
Корозията на металите причинява големи икономически щети. Корозията води до намаляване на надеждността на оборудването: апарати за високо налягане, парни котли, металконтейнери за токсични и радиоактивни вещества. Корозията води до прекъсване на производството поради подмяна на повреденото оборудване, до загуба на суровини и продукти. Корозията също води до замърсяване на продуктите, а оттам и до намаляване на качеството им. Един от американските милионери, без да пести пари, реши да построи най-луксозната яхта. Дъното му беше обшито със скъп метал (сплав от 70% никел и 30% мед), а килът, стеблото и рамката на кормилото бяха направени от стомана. В морската вода в подводната част на яхтата е образуван галваничен елемент с метален катод и стоманен анод. Той работи толкова енергично, че яхтата, дори преди да са приключили довършителните работи, не работи, никога не е била в морето. Понякога зъбните коронки, изработени от различни метали (злато и стомана) и разположени близо една до друга, доставят най-неприятната болка на своите носители. Тъй като слюнката е електролит, тези корони образуват галванична клетка. Електрическият ток преминава през венеца и причинява зъбобол.
Способността на металите да се пасивират се използва широко за защитата им от корозия. Например, известно е, че съхраняването на безопасни бръснарски ножчета в разтвори на соли на хромова киселина им позволява да останат остри по-дълго. Тъй като под действието на влажен въздух желязото, особено по ръба на острието, се окислява и се покрива с хлабав слой ръжда.
За да се предотвратят глобални катастрофи на кораби, фабрики и фабрики, трябва упорито да се изучават методите за защита срещу този проблем. И в същото време е необходимо да се намери приложение за корозията на металите. Едно от направленията може да бъде използването му за разрушаване на конструкции в труднодостъпни места. Изучавайки по-подробно корозията, виждаме, че тя има както отрицателни, така и положителни ефекти. Може да се приложи разрушаване на метали и сплавикато един от начините за справяне с космическите отпадъци. Ако желязото, подобно на среброто и златото, не ръждясваше, тогава ние нямаше да съществуваме и нито едно растение нямаше да е зелено на Земята. Неговата ръжда, разтворена във вода, е част от храната на растенията и им придава зелен цвят. Същата „ръжда” снабдява кръвта ни с желязо и й придава червен цвят.
3. Фиксиране
- Изисква се за закрепване на железни части. Кои нитове трябва да се използват медни или цинкови за забавяне на корозията на желязото? Обосновете отговора.
- Как се наричат инхибиторите на корозията?
- Въвеждането на какви елементи в стоманата повишава нейната устойчивост на корозия?
- Беше предложена защита на протектора на стоманеното дъно на автомобила. Кой метал е по-добре да се използва за това:Zn, Cu или Ni?
- Защо много части корозират по-бързо в близост до фабрики?
- Поцинкован железен лист и калайдиран железен лист бяха издраскани до желязо. Ще корозира ли желязото и в двата случая?
4. Обобщаване
Домашна работа:.направете кръстословица на тема "Корозия на метали".