Уравнение на Клапейрон-Менделеев
n е броят молове на веществото;
R е универсалната газова константа, равна на 8,314;
T - температура по абсолютна скала;
P и V, съответно, са налягането и обемът на газа;
Тъй като n = ; тогава получаваме: РV = RT; следователно M = .
ЕКСПЕРИМЕНТАЛЕН
Определянето на молекулното тегло на кислорода се извършва на устройството, показано на фигурата:

1 4
6 3
1 - колба с вода; 2 - чаша; 3 - сифон; 4 - скоба; 5 - стъклена тръба; 6 - огнеупорна епруветка.
Сглобете устройството според чертежа. Напълнете колба 1 с чешмяна вода. Налейте 50 ml вода в чаша 2. Напълнете сифона с вода. За да направите това, издухайте въздух в устройството през тръбата 5 с отворена скоба 4 и когато сифонът се напълни с вода, затворете скобата 4.
Изсипете около 1 g калиев перманганат в суха епруветка 6. Претеглете епруветката със съдържанието на везна с точност до 0,01 г. Проверете херметичността. Потопете края на сифона в чашата 2.
Отваряйки скобата 4, започнете разлагането на солта чрез нагряване на епруветката 6 със слаб пламък на газова горелка. Нагряването трябва да се извършва много внимателно, като периодично се приближава и отдалечава горелката от епруветката. В този случай реакцията на разлагане не трябва да протича твърде интензивно.
Когато около 100-150 ml вода се изпомпват в чаша 2, спрете нагряването, оставете устройството да се охлади до стайна температура и след това претеглете епруветката отново.
Измерете обема на изместената вода в чашата (извадете предварително добавените 50 ml вода от измереното количество). Обемът на водата ще бъде равен на обема на кислорода, получен при температурата на експеримента.
Определете теглото на получения кислород по разликата в теглото на епруветката преди и след опита.
Обобщете напредъка и наблюденията в таблица.
Приблизителночаст
1. Маса на епруветката със съдържанието преди нагряване (g).
2. Маса на епруветката със съдържанието след нагряване (g).
3. Маса на отделения кислород (разлика 1. и 2.) (g).
4. Обемът на водата в чашата след опита (ml).
5. Обемът на водата в чашата преди експеримента (ml).
6. Обемът на изместената вода, равен на обема на отделения кислород при условията на експеримента (разлика 4. и 5.) (ml).
7. Обемът на кислорода, намален до нормални условия (ml).
8. Температура на въздуха в лабораторията (около С).
9. Атмосферно налягане (kPa).
10. Налягане на водната пара при температурата на експеримента (kPa) таблица 1.
11. Налягане на кислорода в колбата (разлика 9. и 10.) (kPa). Обемът на отделения кислород по време на експеримента се определя по формулата:
V= ;
Молекулното тегло се определя по формулата на Клайперон-Менделеев.
PV=nRT; тъй като n= ;
Замествайки в желаното уравнение, получаваме:
PV= RT; следователно M= ;
Изчислете процента на грешката, като използвате формулата:
%=
където Dt - теоретични газови данни, D - експериментални газови данни.
Налягане на наситените пари на водата при различни температури
| Температура °C | PВ, kPa | температура °C | PВ, kPa |
| 1,70 1,81 1,93 2,06 2,20 2,34 | 2,49 2,64 2,81 2,99 3,17 101,325 |
Въпроси и задачи
1. Методи за изчисляване на молекулни тегла при n.c. и различни от нормалните условия.
3. Изчислете масата на 1 m 3 газове (N.O.) N2O, SiF4, SO2.
4. Масата на 200 ml ацетилен (н.о.) е 0,232 g. Изчислете молекулното тегло на ацетилена.
5. Изчислете масата на азота, съдържащ се в цилиндър с вместимост 20 литра при P = 80 atm и 25 ° C.
6. Маса на 87 ml пара при t=62 o C и 758 mm Hg. колона е 0,24 g.Изчислете молекулното тегло на азота.
7. Изчислете масата на 1 m 3 въздух при t=17 o C P=624 mm Hg. стълб; маса на 1 m 3 CO2 при t=27 o C и P=1 atm.
8. Изчислете обема, който ще поеме 1 kg въздух при t \u003d 17 ° C и P \u003d 1 atm.
9. Масата на 20 ml газ (N.O.) е 0,0268 g. Изчислете молекулното тегло на газа.
10. Изчислете кои газове са по-тежки или по-леки от въздуха: NO2; CO; Cl2; NH3; НЕ; F2 и колко пъти.
Лаборатория #2
ОПРЕДЕЛЯНЕ НА ЕКВИВАЛЕНТНОТО ТЕГЛО НА МАГНЕЗИЙ
ТЕОРЕТИЧНА ЧАСТ
Химически еквивалент е такова количество, което се комбинира с 1 мол водородни атоми или замества същия брой водородни атоми в химични реакции. Например в HCl, H2S, NH3, CH4 еквивалентът на хлор, сяра, азот, въглерод е съответно 1 mol, 1/2 mol, 1/3 mol, 1/4 mol.
Еквивалентната маса е масата на 1 еквивалент от вещество (g/mol). В горните примери еквивалентните маси на хлор, сяра, азот и въглерод са съответно 35,45 g/mol, 32/2=16 g/mol, 14/3=4,67 g/mol, 12/4=3 g/mol.
Стойността на еквивалентната маса на елемент се определя от уравнението:
E=A/B, (1) където
E е еквивалентната маса на елемента;
А е атомната маса на елемента;
B е валентността на елемента в даденото съединение.
Например EAl в Al2O3 е 27/3=9 g/mol; ECa в CaSO4 е 40,08/2=20,04 g/mol.
От уравнение (1) следва, че за разлика от атомната или моларната маса, еквивалентната маса не е постоянна величина, а зависи от валентността на елемента. Постоянни стойности на еквивалентни маси могат да бъдат само за елементи с постоянна валентност.
Концепцията за еквивалентни маси и еквиваленти се прилага и за сложни вещества.
ЕквивалентенСложно вещество е такова количество от него, което взаимодейства без остатък с един еквивалент водород или с един еквивалент на всяко друго вещество.
Еквивалентната маса на дадено вещество се изчислява от неговата моларна маса:
, Където
M е моларната маса.
Основността на една киселина се определя от броя на водородните атоми, които една киселинна молекула отдава, когато реагира с основа.
Киселинността на основата се определя от броя на протоните, прикрепени към основната молекула, когато тя взаимодейства с киселина.
Подобно на еквивалентната маса на елемент, еквивалентната маса на съединение може да има множество стойности в зависимост от реакцията, в която участват веществата.
Например в реакция:
Еквивалентната маса на киселина е равна на нейната моларна маса:
Законът за еквивалентите
Масите на веществата, взаимодействащи помежду си, са пропорционални на техните еквивалентни маси (еквиваленти):
(2), където
mA и mB са масите на взаимодействащите вещества A и B;
EA и EB са еквивалентните маси на тези вещества.
Уравнение (2) е математически израз на закона за еквивалентите.
ЕКСПЕРИМЕНТАЛЕН
Целта на работата е да се определи еквивалентната маса на магнезия. Експериментът се провежда на инсталация, чиято схема е показана на фигурата по-долу.
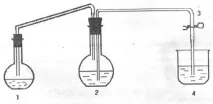
където, 1 - реакционна колба; 2 - кръгла колба с плоско дъно; 3 - скоба; 4 - стъкло.
РАБОТА
1. Претеглете около 0,1 g магнезий на техническа везна с точност до 0,01 g.
2. Сглобете уреда съгласно схемата.
3. Налейте приблизително 25-30 ml разредена сярна киселина в колбата (1). Избършете подсушете вътрешната стена на гърлото на колбата (1) с филтърна хартия.
4. Напълнете колбата (2) до 3/4 от обема с вода и затворетенеговата запушалка с изходни тръби. Чрез издухване на въздух през късата тръба, напълнете дългата тръба с вода и затворете скобата (3). Уверете се, че скобата се държи.
5. Изсипете 50 cm 3 вода в чаша (4) и спуснете дълга изходна тръба от колбата (2) в нея.
6. Поставете колбата (1) в хоризонтално положение и изсипете измерено количество магнезий върху сухата стена на гърлото (металът не трябва да попада в киселината!).
7. Затворете колбата (1) със запушалка с къса изходна тръба на колбата (2). Затворете внимателно и внимателно. Колбата трябва да се държи за гърлото, тапата трябва да се затвори внимателно и постепенно, като леко се завърта. (Уверете се, че магнезият попада в КИСЕЛИНАТА!).
8. Поставете колбата (1) във вертикално положение, като в същото време бързо отворете скобата (3) и я оставете отворена.
9. Наблюдавайте взаимодействието на магнезий с киселина и изместването на водата от колба (2) в стъкло 4 от водород.
10. Когато целият магнезий е реагирал с киселината, затворете скобата (3), извадете изходната тръба от чашата (4) и измерете обема на водата в чашата с цилиндър.
11. Извадете 50 cm 3 от получения обем (т.е. количеството вода, което е излято в чашата преди експеримента).
12. Разликата ще бъде равна на обема отделен водород V1.
ОБРАБОТКА НА РЕЗУЛТАТИТЕ
1. Напишете уравнението на реакцията за взаимодействие на магнезий с разредена сярна киселина.
2. Доведете намерения обем водород (V1) до нормални условия съгласно формулата:
, Където
V0-обем водород при нормални условия, cm3;
Р - барометрично налягане, kPa;
Pw е налягането на наситените водни пари при температурата на експеримента, kPa;
T1 е температурата на експеримента, K. T1 = 273 + t.
3. Изчислете масата на изместения водород, определете еквивалентната маса на магнезия.
РЕЗУЛТАТИ ОТ ОПИТ
Температура на експеримента, °С -
Барометрично налягане, kPa -
Тегло на магнезия, g -
Налягане на наситени водни пари, kPa -
Обемът на водорода при условие на опит, cm 3 -
Маса на водород, g -
Еквивалентна маса на магнезий, g/mol -
Налягане на наситените пари на водата при различни температури
| температура °С | PВ, kPa | температура °C | PВ, kPa |
| 1,70 1,81 1,93 2,06 2,20 2,34 | 2,49 2,64 2,81 2,99 3,17 101,325 |
Изчислена част
От обема, изместен при нормални условия на водород (V0), се изчислява масата на обема. Като се има предвид, че масата на водорода е 22,4 литра при нормални условия (n.o.) тежи 2 g, се намира масата на H2.
22.4 H2 тежи - 2.0 g.
mH2=
Въз основа на известните маси на изразходвания магнезий (mMg) и изместения от него водород се определя еквивалентната маса на магнезия:
Полученият резултат се сравнява с еквивалентната маса, изчислена по формулата:
EMg= , където
А е атомната маса на метала; B е валентността на метала.
ВЪПРОСИ И ЗАДАЧИ
2. Изчислете еквивалента на азот в съединенията му с кислород: N2O, NO, NO2, N2O3, N2O5.
3.Колко оксид се получава при окисляване на 3 g метал, чиято еквивалентна маса е 9 g/mol.
4. Определете еквивалентните маси на киселини и основи:
5. Какъв обем ще бъде зает при n.o.s. маси на един еквивалент на кислород и водород.
6. Определете еквивалента на метала, ако 0,046 g от него се измести от киселината с 62,35 ml H2 при t=17°C и налягане 1,017×10 5 Pa. Налягането на водните пари при 17°C е 0,193×10 5 Pa.
7. Изчислете: а) еквивалентната маса на калай, ако при нагряване 0,92 g от негов поток от кислород се образува 1,17 g калаен оксид;
б) магнезий, ако при нагряване в поток от кислород масата му се увеличава с 66,7%.
8. Изчислете еквивалента на сярна киселина в реакция с КОН:
9. Изчислете еквивалента на Ca(OH)2 и H3PO4, изчислете колко грама Ca(OH)2 ще са необходими за неутрализиране на 150 g H3PO4.
Лаборатория #3
Не намерихте това, което търсихте? Използвайте търсенето в Google на сайта: