1. ИНФОРМАЦИЯ ЗА КОРОЗИЯ НА МЕТАЛИ
За да се определят правилно причините за разрушаването на метала, от който е направен обектът, за да се спре и предотврати този процес, е необходимо да се познават някои основи на теорията за корозията и защитата на металите. Способността за разграничаване на видовете корозия е необходима както за реставратора, за да оцени правилно състоянието на метала, когато съставя точно описание в реставрационния паспорт и избира най-подходящия метод за реставрация, така и за попечителя да определи промените, които са започнали, и опасността от тези промени за безопасността на обектите.
Според механизма на разрушаване се разграничават химична и електрохимична корозия.
Химическата корозия възниква, когато метал влезе в контакт със сухи газове или въздух, в неелектролитни течности, т.е. непроводим електрически ток. Този тип корозия включва по-специално окисляването на металите - образуването на тънък слой от оксиди на повърхността, което води до пасивност. Електрохимична корозия възниква, когато има физична и химична нееднородност на повърхността на метал или среда в присъствието на течност, която провежда ток - електролит. Тъй като върху повърхността на метала почти винаги има филм от влага, често най-тънкият, почти невидим, съдържащ разтворени соли, които влизат в него от атмосферата, с прах, от почвата, т.е. провеждащ ток и повърхността на метала не е хомогенна, тогава металните предмети се разрушават поради електрохимична корозия.
По време на електрохимичната корозия на металите протичат два основни процеса:
1) аноден процес - преходът на метал в разтвор под формата на хидратирани йони или неговото окисление; в този случай съответният брой електрони остава в метала;
2) катоден процес - абсорбция на излишните електрони, които се появяват в метала от деполяризатори, които могат да бъдат атоми,молекули или йони на разтвор, подложен на редукция върху цялата повърхност на метала или отделните му участъци.
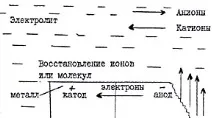
Преходът на метални йони в разтвор (разрушаване)
Пример за анодна реакция:
Fe → Fe 2+ + 2e окисление на желязото
Най-общо: Аз → Мъже + +не -.
Примери за катодни реакции: 2H + + 2e → 2H→ H2 - редукция на водородни йони в кисела среда;
2H + + 2H2O + 4e → 4OH - - редукция на разтворен кислород в неутрална или алкална среда.
По този начин площите на анодната повърхност се разрушават. Теоретично, за анодната реакция трябва да настъпи равновесие и, следователно, прекратяване на разрушаването. На практика това равновесие не се постига поради факта, че по време на корозия химичният състав на разтвора в близост до металната повърхност се променя в резултат на вторични реакции, например образуване на метални хидроксиди, отстраняване на йони от повърхността и отделяне на газове.
Идеалният баланс и спиране на разтварянето може да се постигне само при пълна химична и физична хомогенност както на метала, така и на електролита и при невъзможност за странични реакции на метални йони. Тъй като такава идеална еднородност е недостижима, на практика процесът на разтваряне или корозия може да продължи, макар и много бавно, до пълното разрушаване на метала.
По този начин процесът на електрохимична корозия може да бъде много приблизително оприличен на процеса, протичащ в обикновена галванична клетка. Електродвижещата сила на галваничния елемент зависи от активността, проявена в реакциите на изместване на металите един от друг от разтвори на техните соли.
В зависимост от тази активност металите се подреждат в следните електрохимични сериинапрежение: Li, K, Ca, Na, Mg, Be, Al, Ti, Zr, Mn, Nb, Zn, Cr, Fe, Cd, Co, Ni, Mo, Sn, Pb, N, Cu, Hg, Pd, Ag, Pt, Au. Всеки метал, стоящ отляво в ред, може да измести всички следващи метали от разтвори на техните соли, понастоящем няма методи за експериментално измерване на абсолютната стойност на потенциала на метала, поради което стойността му в справочниците се дава спрямо, например, водороден референтен електрод. При контакт на разнородни метали, а такива случаи са доста чести в практиката, например инкрустация на желязо с мед, сребро или злато, сребърно покритие върху медна сплав и др., възниква особен вид електрохимична корозия -контактна корозия.
Според потенциалите на два метала в даден електролит може да се посочи кой от тях ще забави корозията на другия и кой ще ускори: металът с по-положителен потенциал, т.е. стоящ отдясно в поредица от напрежения, ускорява катодния процес и допринася за корозията на метала, с който е сдвоен. При реални условия металите могат да бъдат покрити с оксидни филми, което променя тяхното електрохимично състояние, а експерименталните данни могат да противоречат на теоретичните прогнози. Когато металите влязат в контакт, корозията възниква най-интензивно в близост до кръстовището на два различни метала. Контактът на различни метали обяснява бързото химическо разрушаване на запоените продукти точно на мястото на запояване. В допълнение, скоростта на корозия на анодния метал в контактната двойка се влияе от съотношението на анодната и катодната площ. Например, при съединяване на медни листове със стоманени нитове, последните се подлагат на разрушаване за кратко време. На обратната снимка, когато стоманени листове са свързани с медни нитове, има леко увеличение на корозията в близост до медните нитове.Известно покритие на желязо с цинк и калай. Въз основа на електрохимичните серии от напрежения, цинкът трябва да защитава желязото, докато калайът трябва да увеличи корозията. Калайдисаното покритие чисто механично предпазва ютията и е достатъчно да се наруши целостта на ламарината на едно място, тъй като ютията започва да се руши. Ситуацията е различна с цинковото покритие: докато целият цинк не се разтвори, желязото не корозира. Контактната корозия се предотвратява чрез избор на подходящи материали с малка потенциална разлика, електрическа изолация на различни метали един от друг и др. Скоростта на електрохимичната корозия зависи от вътрешни и външни фактори. Вътрешните включват фактори, свързани с естеството на метала, неговия химичен състав, структура и наличието на неметални включвания. Много чистите метали се разрушават бавно. Чуждите включвания значително намаляват устойчивостта на металите, двуфазните сплави корозират много по-бързо от еднофазните. Корозията се развива по-бързо в напрегнатите участъци на металните изделия, отколкото в ненапрегнатите - по-деформираните участъци стават аноди и са подложени на по-голямо разрушаване; лятият метал се разпада по-малко от кования. Фината повърхностна обработка (шлайфане, полиране) като правило повишава корозионната устойчивост на металите, улеснявайки образуването на защитни филми върху повърхността.
Външните фактори включват естеството и свойствата на корозивната среда и параметрите й. Скоростта на електрохимичната корозия се влияе от концентрацията на водородни йони в електролитния разтвор (т.нар. pH на средата). За всеки метал има определена стойност на pH на разтвора, при която скоростта на корозия е минимална. Известно е например, че желязото е пасивно в млечната среда. Температурата има значително влияние, тъй като променя скоростта на дифузия и разтворимосттапродукти от корозия.
В зависимост от външните условия се разграничават атмосферна корозия и почвена корозия.
Атмосферната корозия е изложена на паметници на открито, в условията на музейно съхранение и експозиция. Атмосферната корозия е разделена на три вида, въпреки че това разделение е условно, тъй като в реални условия е възможен преходът на един вид корозия към друг:
1) "Сухата" корозия протича при пълна липса на следи от влага върху металната повърхност. Повечето метали, когато взаимодействат с атмосферен кислород или други окислители в суха атмосфера, се покриват с оксиден филм. По своя механизъм този процес е чисто химичен и не води до значително разрушаване на метала. Дебелината на филмите варира в широк диапазон:
а) тънки (невидими), чиято дебелина е от няколко до 400 А;
б) среден (даващ оттенъци), чиято дебелина е от 400 до 5000 А;
в) дебели (видими), чиято дебелина е над 5000 А.
Във филмите, образувани върху метали, когато се удебеляват, могат да възникнат вътрешни напрежения, които причиняват механично разрушаване на филмите със загуба на защитни свойства, тъй като само непрекъснатите филми имат защитни свойства. В двукомпонентна сплав окисляването започва с образуването на оксид, по-малко благороден компонент на сплавта, т.е. по-малко термодинамично стабилен (например медният компонент на сплавта се окислява в нискокачествено сребро).
2) "Мокра" атмосферна корозия - корозия при наличие на най-тънък, невидим филм от влага върху металната повърхност, който се образува в резултат на кондензация при относителна влажност на въздуха под 100%. Концепцията за относителна влажност често се среща в практиката, така че припомняме, че относителната влажност е съотношениетодействителното съдържание на водни пари във въздуха до максимално възможното при дадени условия. Средната относителна влажност в градовете е 70-80%, а в някои летни месеци -60-65%. В музейните зали и хранилища се поддържа влажност на същото ниво. При тази стойност има всички условия за овлажняване на металната повърхност. Кондензацията се улеснява от температурни промени. Например при температура от +25°C и влажност 50% се образува кондензат, когато металът се охлади до +14°C, ако влажността на въздуха е 90%, тогава кондензат се образува при температурна разлика от 1°C, т.е. вече при +24°C. Влажността, при която скоростта на корозия рязко се увеличава, се нарича критична. Критичната стойност за относителна влажност е около 70%, но при определени условия е много по-ниска.
Стойността на критичната влажност варира в зависимост от състоянието на металната повърхност и състава на атмосферата. Така че в присъствието на серен диоксид или други активни реагенти в атмосферата, то може да падне до 50%.
3) "Мокра" атмосферна корозия - корозия при наличие на видим филм от влага върху металната повърхност. Атмосферна корозия от този тип се наблюдава при относителна влажност на въздуха около 100%, когато има капкова кондензация на влага върху металната повърхност, както и когато влагата директно удари метала, например по време на дъжд.
Кондензацията на влага е толкова вреден процес, че металите под навес могат да корозират по-интензивно, отколкото при открити условия на излагане, където дъждът бързо отмива киселините, образувани на повърхността по време на кондензацията, т.к. влагата, кондензираща върху металната повърхност вечер, когато температурата спадне, често е по-кисела от дъждовната вода.
Влиянието на въглеродния диоксид е двусмислено. В някои случаи топрисъствието дори възпрепятства корозията. Хлорният газ силно ускорява корозията. Освен това е характерно, че в присъствието на този газ корозията се увеличава и в относително суха атмосфера (влажност под 42%). Сероводородът при висока влажност също е много силен реагент. В допълнение към газовете и киселинните пари, процесът на корозия се влияе значително от твърди частици, отложени върху металната повърхност от въздуха. Някои от тях (корозионни) имат пряк ефект върху метала, други, въпреки че не се различават по корозивни свойства, например частици от въглища, водят до ускоряване на корозията поради факта, че допринасят за адсорбцията на серен диоксид върху металната повърхност. Ето защо отлагането на прах и мръсотия върху метални предмети в музеите е недопустимо. Особено опасни места са подрязванията на високите релефи. Известни са случаи на развитие на корозионен процес върху бронзова скулптура, стояща в залите и незащитена от витрини.
Биокорозия. Микроорганизмите, открити в големи количества в почвите, могат да ускорят разграждането на черните метали. Особено активни са анаеробните сулфат-редуциращи бактерии, които се развиват в тинести, глинести и блатни почви.
От аеробните бактерии опасни са серните бактерии, които в хода на своята жизнена дейност окисляват сероводорода в сяра и след това в сярна киселина. Получената сярна киселина причинява интензивна корозия.
Морска корозия. Морската вода е добре аериран (8 mg/l 02), неутрален (pH 7,2-8,6) електролит с висока електропроводимост, дължаща се на разтворени соли, главно хлориди и сулфати на натрий, магнезий, калций и калий. Общата соленост на морската вода варира от 1 до 4%. В морската вода металните предмети са покритислоеве от растителни и животински организми. Заедно със силициевите съединения и калциевия карбонат, те дават отлагания върху метала, които могат да имат защитен ефект. При обекти, намиращи се в зоната на периодично намокряне, корозията протича с повишена скорост поради улеснения достъп на кислород до металната повърхност.
Според характера на корозионното разрушаване се разграничават: 1) непрекъсната или обща корозия и 2) локална корозия , Непрекъснатата корозия е равномерна, която протича с еднаква скорост по цялата повърхност на метала. Металните предмети, които са в музейни условия, са покрити с оксиден филм с еднаква дебелина, който се грижи внимателно: върху тях не се натрупва прах, агресивни вещества не попадат, например от ръцете или при почистване на стаята. Твърдата корозия също е неравномерна и протича с различна скорост в различните части на металната повърхност. Този вид корозия включва унищожаването на археологически метал. При атмосферни условия преди образуването на патина корозията също има неравномерен характер.
Локалната корозия води до разрушаване на отделни участъци от повърхността на метален предмет. Корозията може да бъде под формата на тъмни петна, точки (вдлъбнатини), язви под формата на черупки. Това са най-честите повреди на музеен метал. Към този тип разрушаване спадат случаите на "бронзова болест", които ще бъдат разгледани подробно в раздела "Счупване на медни сплави". Локалната корозия също включва междукристална корозия - разрушаване по границите на кристалитите (този тип корозия е опасен, тъй като, без да променя външния си вид, металът губи здравина и пластичност), чрез корозия, корозионно напукване - разрушаване на метала, докато е изложен на корозивна среда и външна иливътрешни механични напрежения.
Когато ръцете без ръкавици влязат в контакт с предмет, металът взаимодейства с потта. Чести са случаите на образуване на корозионно петно върху повърхността на музеен експонат, което възпроизвежда пръстов отпечатък.
Потта съдържа, освен вода (98-99% от теглото), млечна киселина, урея, натриев хлорид, което определя нейната агресивност.