23. Кислород и неговите свойства
Кислород (O)е в период 1, група VI, в основната подгрупа. p-елемент. Електронна конфигурация1s22s22p4. Броят на електроните във външното ниво е 6. Кислородът може да приеме 2 електрона и в редки случаи да ги отдаде. Кислородна валентност 2, степен на окисление -2.
Физични свойства:кислород(O2)– безцветен газ, без мирис и вкус; слабо разтворим във вода, малко по-тежък от въздуха. При -183 °C и 101,325 Pa кислородът се втечнява, ставайки синкав на цвят.Молекулна структура:Молекулата на кислорода е двуатомна, силна при нормални условия и има магнитни свойства. Връзката в молекулата е ковалентна неполярна. Кислородът има алотропна модификация -озон(O3) -по-силен окислител от кислорода.
Химични свойства:Кислородът се нуждае от 2 електрона, за да завърши енергийното ниво, което приема в степен на окисление -2, но в комбинация с флуор кислородът е OF2 -2 и O2F2 -1. Благодарение на своята химическа активност, кислородът взаимодейства с почти всички прости вещества. Образува оксиди и пероксиди с метали:
Кислородът не реагира само с платината. При повишени и високи температури той реагира с много неметали:
Кислородът не взаимодейства директно с халогените. Кислородът реагира с много сложни вещества:
Кислородът се характеризира с реакции на горене:
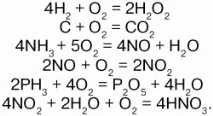
Много органични вещества изгарят в кислород:
Когато ацеталдехидът се окислява с кислород, се получава оцетна киселина:
Получаване:в лаборатория: 1) чрез електролиза на воден разтвор на алкали: в този случай водородът се отделя на катода, а кислородът на анода; 2) разлагане на бертолетова сол при нагряване: 2KSlO3?2KSl + 3O2?; 3) получава се много чист кислород:2KMnO4?K2MnO4 + MnO2 + O2?.
Среща се в природата:Кислородът съставлява 47,2% от земната кора. В свободно състояние се съдържа в атмосферния въздух - 21%. Той е част от много природни минерали, огромно количество от него се намира в организмите на растенията и животните. Естественият кислород се състои от 3 изотопа: O(16), O(17), O(18).
Приложение:използва се в химическата, металургичната промишленост, медицината.
24. Озон и неговите свойства
В твърдо състояние кислородът има три модификации: ?-, ?- и ?- модификации.Озон (О3) –една от алотропните модификации на кислорода. Молекулярна структура:Озонът има нелинейна молекулна структура с ъгъл между атомите от 117°. Молекулата на озона има определена полярност (въпреки атомите от същия вид, които образуват молекулата на озона), тя е диамагнитна, тъй като няма несдвоени електрони.
Физични свойства:Озонът е син газ с характерна миризма; молекулно тегло = 48, точка на топене (твърдо) = 192,7 °C, точка на кипене = 111,9 °C. Течният и твърдият озон са експлозивни, токсични и силно разтворими във вода: при 0 °C до 49 обема озон се разтварят в 100 обема вода.
Химични свойства:Озонът е силен окислител, той окислява всички метали, включително злато до Au и платина до Pt (и метали от платиновата група). Озонът действа върху лъскава сребърна пластина, която моментално се покрива с черен сребърен пероксид - Ag2O2; хартията, навлажнена с терпентин, се запалва, серните съединения на металите се окисляват до соли на сярна киселина; много багрила са обезцветени; разрушава органичната материя - докато молекулата на озона отделя един кислороден атом и озонът се превръща в обикновен кислород. И мнозинствотонеметали, превръща по-ниските оксиди в по-високи и сулфидите на техните метали в техните сулфати:
Озонът окислява калиевия йодид до молекулярен йод:
Но с водороден пероксид H2O2 озонът действа като редуциращ агент:
Химически молекулите на озон са нестабилни - озонът може спонтанно да се разложи до молекулярен кислород:
Получаване:Озонът се произвежда в озонови генератори чрез преминаване на електрически искри през кислород или въздух. Образуване на озон от кислород:
Озонът може да се образува при окисляването на мокър фосфор, смолисти вещества.Детектор за озон:за да се установи наличието на озон във въздуха, е необходимо да се потопи във въздуха хартия, напоена с разтвор на калиев йодид и паста от нишесте - ако хартията е посиняла, това означава, че във въздуха има озон.Среща се в природата:В атмосферата озонът се образува по време на електрически разряди.Приложение:Като силен окислител, озонът унищожава различни видове бактерии, поради което се използва широко за пречистване на вода и дезинфекция на въздуха и се използва като избелващ агент.