3.5.2. Йонообменно равновесие
Йонообменът, както всяка химическа реакция, се подчинява на общите термодинамични закони на равновесието. Проникването на вода в зърното на йонообменника причинява дисоциация на йоногенни групи, която е по-малка, отколкото в разтвора, но достатъчна, за да може йонът свободно да дифундира, така че матрицата може да се разглежда като аналог на йон в електролитен разтвор. По този начин, когато разтворът на електролита влезе в контакт с йонообменника, настъпва йонообмен, който продължава до достигане на равновесие. Реакцията протича обратимо в еквивалентни съотношения. Най-общо реакцията на обмен на йони А и В се описва с уравнението
или в йонна форма, като се вземе предвид зарядът на йоните
(3.5.1)
където zA и zB са зарядите на йони A и B, фазата на йонообменника е отбелязана с черта отгоре.
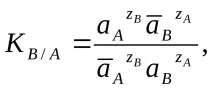
където āА, āВ и аА, аВ са активностите на йоните в йонообменника и разтвора.
C
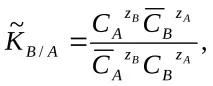
r

Числената стойност на концентрационната константа зависи от единиците, в които са изразени концентрациите. Тази константа е безразмерна величина, когато се изразяват равновесните концентрации в молни фракции или за реакции между йони с еднакъв заряд, независимо от избора на единициконцентрации.
За описание на равновесното състояние, в допълнение към йонообменните константи, на практика се използват коефициентът на разпределение D и коефициентът на разделяне (селективност, селективност) TV / A.
Коефициентът на разпределение K
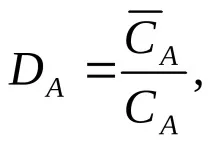
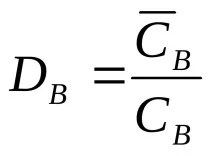
K
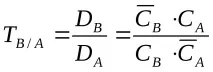
Когато зарядите на обменените йони са равни, константата на равновесие на концентрацията и факторът на разделяне са равни, а при обмен на йони с различен заряд те могат да се различават значително. Селективността е важно свойство на йонообменника, което характеризира неговата способност да разделя йони и способността селективно да абсорбира отделни йони или групи йони от тяхната смес. Някои смоли показват висока селективност за един йон спрямо много други. В този случай се говори за спецификата на йонообменника, която е свързана с особеностите на чисто химичното взаимодействие на йонообменника с йона.
При TB/A1 йонообменникът е селективен към йон B в сравнение с йон A, а при TB/A1 йон A се сорбира селективно. От гледна точка на термодинамиката, йонообменникът ще бъде селективен по отношение на B йон в сравнение с A йон, ако разликата в промяната на енергията на Гибс по време на прехода на B и A йони от външния разтвор към йонообменника е по-малка от нула:
(3.5.6)
където G и G са разликите между енергиите на Гибс на йони във външен или вътрешен разтвор и идеален разтвор.
Промяната в енергията на Гибс по време на прехода на йони от външен разтвор към вътрешен се определя от два основни фактора: разликата в енергията на хидратация на йоните и енергията на тяхното електростатично взаимодействие сйони с противоположен знак (фиксирани йони във вътрешния разтвор, койони във външния разтвор). Въз основа на сравнение на тези стойности и общата промяна в енергията на Гибс по време на прехода на йони от външен разтвор към вътрешен, се предлагат серии на селективност за катионни обменници и анионобменници. При съставянето на серията се взема предвид, че електростатичното взаимодействие между йони във вътрешния електролит е по-изразено, отколкото във външния разтвор. Това се дължи на по-ниската степен на хидратация на йоните в концентрирания разтвор на йонитната фаза, по-малкото средно разстояние между йоните и по-ниската стойност на диелектричната проницаемост.
Серии за селективност на катиони
В зависимост от вида на фиксираните йони и обменните катиони, експериментално са установени различни серии от селективност на катиони.
При обмен на еднократно заредени йони върху силно кисел сулфонов катионен обменник е установена следната серия на селективност:
Li + H + Na + NH4 + K + Rb + Cs + Ag + Tl + .
Йонообменът на двойно заредени йони се характеризира със следните серии:
Mg 2+ Ca 2+ Sr 2+ Ba 2+ Ra 2+
Всеки следващ член на поредицата се сорбира по-селективно от предишния. Определящият фактор в тези серии на селективност е промяната в енергията на хидратация. Тъй като енергията на хидратация намалява с увеличаване на размера на йоните, селективността на сулфоновия катионен обмен към катиони се увеличава с увеличаване на техния радиус. Електростатичното взаимодействие в този случай има малък ефект върху селективността на обмена, тъй като фиксираният сулфоанион има голям размер и слабо силово поле.
За различно заредените катиони селективността нараства с увеличаване на заряда. В този случай селективността е доминирана от електростатичновзаимодействие, което нараства с увеличаване на йонния радиус.
В случай на слабо киселинни карбоксилни и катионни обменници, както и смоли с фосфатни групи, се наблюдават обратни серии на катионна селективност в сравнение със сулфоновите катионни обменници, например за алкални метали:
Li + Na + K + Rb + Cs + .
Тези катионообменници са склонни да бъдат по-селективни по отношение на йони с малък радиус, което се обяснява с преобладаващото влияние на енергията на електростатичното взаимодействие върху селективността. Така например, фиксираният анион -COO - е по-малък от -SO3 - групата, освен това един кислороден атом има заряд от -1/2, вместо -1/3, както в сулфо групата, и двата фактора допринасят за увеличаване на енергията на електростатичното взаимодействие.
Серии за селективност на аниони
В анионообменниците фиксираните йони се състоят от голям брой атоми, големи са по размер и имат положителен заряд, равен на единица. Тъй като в някои случаи подходът на противойони към фиксирани катиони е пространствено труден, следователно решаващата роля играе не електростатичното взаимодействие между тях, а промяната в енергията на хидратация на аниони по време на прехода от външен разтвор към йонообменник. Подобно на катионообменниците, по-малко хидратираните аниони преминават от разтвора към йонообменната фаза. Енергията на хидратация на йони с еднакъв заряд намалява с увеличаване на йонния радиус, което обяснява серията от селективност на абсорбция на еднократно заредени йони върху силно основен анионобменник
OH - F - HCOO - Cl - HSO3 - Br - NO3- HSO4 - I - ClO4 - .
Освен това големите аниони нарушават структурата на водата в по-голяма степен от по-малките аниони. В резултат на това е по-изгодно да се прехвърлят във фазата на смолата, където водната структура е по-малко подредена. Следователно със същзаряд, по-малките аниони се изместват от йонообменника от по-големите аниони. Това обяснява високата селективност на силно базичните анионобменници по отношение на големи еднократно заредени йони AuCl4-, ReO4-, MnO4-, ClO4-.
С увеличаване на заряда на анионите селективността на тяхната абсорбция намалява, тъй като енергията на хидратация се увеличава. Степента на хидратация на многоатомните аниони зависи не само от размера, но и от структурни фактори, особено от наличието на хидрофилни групи, които определят взаимодействието с водните молекули. Сериите на селективност на аниони са характерни за високоосновни анионобменници, докато данните за сорбция на нискоосновни анионобменници са практически необобщаеми.
Както за катионните, така и за анионните обменници, селективността се увеличава с увеличаване на степента на омрежване, което намалява набъбването.
Йонообменни изотерми
Задачата както на аналитичното, така и на графичното описание на йонообменното равновесие е да изобрази връзката между съставите на фазите на йонообменника и разтвора. За разлика от други хетерогенни системи, йонообменните системи не са много чувствителни към температурни промени, поради което изотермите на йонообмен не се отнасят до строго определена температура, а обикновено характеризират равновесие в температурния диапазон от 15 до 30 С. Йонообменните изотерми изобразяват графично връзката между еквивалентната фракция на йон в йонообменник и неговата еквивалентна фракция в разтвор при установяване на равновесие между йони, вариращи в диапазона от 0 до 1, така наречената квадратна диаграма (фиг. 3.5.3.). Така че за системата
ако зарядите на йони А и В са равни, еквивалентните фракции на йони А и В в йонообменника ще бъдат
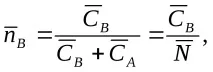
и техните еквивалентни дялове в разтвора
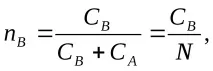
(

С и N са общите концентрации на йони в йонитната фаза и във външния разтворсъответно.
Заменяйки моларните концентрации в израз 3.5.3 с техните еквивалентни фракции и като вземем предвид, че стойността на N при условията на квадратна диаграма е 1, а зарядите на йони A и B са равни, ние го трансформираме по отношение на йон B. В резултат на това получаваме следното уравнение на изотермата: