4.6. Концепцията за хибридизация на атомните орбитали.
Нека разгледаме структурата на молекулата на съединението на берилий с водород BeH2 (берилиев хидрид), в което водородът има валентностI, а берилият има валентностII.
Графично представяне на молекулата BeH2:
H I - Be II - H I .
В това съединение водородният атом 1H1s1, в който единственият електрон е разположен в сферична атомна орбитала, е свързан с берилиевия атом.
Електронна графична формулаводороден атом:
Форма на водородната орбита:

Електронна формула на берилиевия атом:4Be 1s2 2s2

и формата на орбиталата на атома
Както се вижда от електронно-графичната формула, атомът на берилий няма несдвоени електрони и валентността на берилия в основното състояние е нула. Атомът на берилий проявява валентност, равна на две във възбудено състояние -4Be٭ 1s2 2s1 2p1:
Електронна графична формула на атома на берилий
при възбуда:
По този начин, в берилиев атом, образуването на химическа връзка трябва да включва електрони, разположени в две различни атомни орбитали 2sи 2pи имащи различни форми и различни енергии. Но енергиите на всяка от двете връзки в молекулата BeH2 имат еднакви стойности. Изравняването на енергиите на различните атомни орбитали се дължи на феноменахибридизация.
Хибридизациятае феномен, при който две или повече атомни орбитали с различни енергии и различни форми образуват същия брой модифицирани орбитали с еднаква енергия.
В нашия случай в хибридизацията участват атомни орбитали на единs- и единp-електронsp-хибридизация (фиг. 4.19).
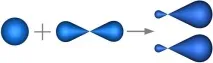
Фиг. 4.19. Форми на оригиналните и хибридизираните орбитали на берилиевия атом.
При такава хибридизация се образуват 2 хибридни орбитали, които са разположени на една и съща ос и са ориентирани една спрямо друга под ъгъл от 180 ° (фиг. 4.20).
180 0

Фиг. 4.20. Местоположение на две и sp-хибридизирани орбитали в пространството.
Това подреждане на хибридни орбитали определя линейната форма на молекулата. Две сферични орбитали на два водородни атома се припокриват с двеspхибридни орбитали на берилий (фиг. 4.21).
Фиг. 4.21. Припокриване на атомни орбитали в молекулаBeH2
Примери за химични съединения, които се характеризират с sp-хибридизация: BeCl2, BeH2,CO,CO2,HCN. Същоsp-хибридизация се наблюдава във всички ацетиленови въглеводороди (алкини) и някои други органични съединения.
Вsp2 -хибридизациятаучастват атомни орбитали на единs- и дваp-електрона (фиг. 4.22).
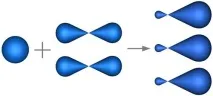
Фиг. 4.22. Орбитални форми заsp2хибридизация.
В резултат на хибридизацията се образуват три хибридниsp2 орбитали, разположени в една и съща равнина под ъгъл 120 ° една спрямо друга (фиг. 4.23).

Фиг. 4.23. Местоположение на орбиталите в пространството при sp2-хибридизация.
Формата на молекула с три хибридни sp 2 орбитали е плосък триъгълник. Такава форма има например молекулата на алуминиевия хлорид AlCl3. Схемата на припокриване на електронни орбитали в тази молекула е показана на фиг. 4.24.
Примери за други съединения, в които се извършваsp2 -хибридизация, са молекули: BCl3, SO3, BF3 и йони:
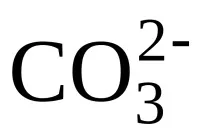

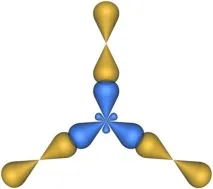
Фиг. 4.24. Припокриване на атомни орбитали в молекулаAlCl3
Например в молекула на етилен (C2H4) и двата въглеродни атома във възбудено състояние (sp2 хибридизация) са свързани един с друг чрез двойни химични връзки, образувайки една σ-връзка и една π-връзка. Още две σ-връзки, които всеки въглероден атом образува, когато се комбинира с водородни атоми.
Вsp3-хибридизациятаучастват еднаs- и триp- атомни орбитали (фиг.4.25).
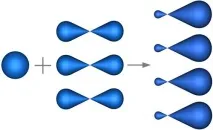
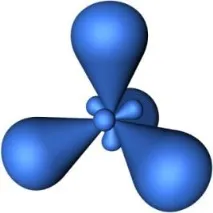
Фиг. 4.25. Образуванеsp3-хибридни орбитали.
От четирите обикновени атомни орбитали се образуват същия брой модифицирани хибридни орбитали, които са симетрично ориентирани в пространството под ъгъл 109 ° 28'. Пространствената конфигурация на молекула, чийто централен атом е образуван отsp3 хибридни орбитали, е тетраедър.
Схемата на припокриващи се електронни облаци в молекула метан (CH4), в която въглеродният атом е вsp3 хибридизация, е показана на фиг. 4.26.
Примери за съединения, които се характеризират сsp3 хибридизация: NH3, POCl3, SO2F2, SOBr2, NH 4+, H3O +. Също такаsp3 хибридизация се наблюдава във всички наситени въглеводороди (алкани, циклоалкани), някои други органични съединения.
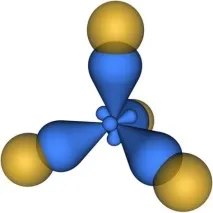
Фиг. 4.26. Схема на припокриващи се електронни облаци в молекулата на метана CH4
Трябва да се има предвид, че пространствената конфигурация на молекула с тип хибридизацияsp3 не винаги съответства на тетраедър.
Например в молекулата на амоняка (NH3), валентността на азотния атоме III и неговите пет електрона от външно ниво заемат четири орбитали (еднаsи триp). Всички те участват в хибридизацията (тип хибридизация -sp3 ), но само три орбитали (p-орбитали) участват в образуването на химична връзка. Тетраедър без един връх се превръща в пирамида. Следователно молекулата на амоняка има пирамидална форма, ъгълът на свързване е изкривен до 107°30′. Подобни разсъждения за структурата на водната молекула (H2O) ни водят до факта, че кислородът е в хибридно състояниеsp3, а формата на молекулата е ъглова, ъгълът на връзката е 104°27′.