Алуминий и основните му съединения - Химия
МИНИСТЕРСТВО НА ОБРАЗОВАНИЕТО НА БЪЛГАРИЯ
Държавно учебно заведение
висше професионално образование
"Мичурински държавен педагогически институт"
Ученик от 12 група
Попов Дмитрий Иванович
Алуминий и неговите основни съединения
Ръководител: Okolelov O.S.
Глава I. Свойства на алуминия
1.2. Химични свойства
1.3. Намиране в природата и приложение
Глава II. Основни връзки
2.1. алуминиеви оксиди
2.2. Алуминиеви хидроксиди
2.3. Алуминати. Алуминатни разтвори
Алуминият е открит от Х. Ерстед през 1825 г. Този елемент принадлежи към p-елементите на основната подгрупа от група III на периодичната система на химичните елементи на D.I. Менделеев.
Радиусът на атома е 0,143 nm. Нека го запишем. В почти всички съединения алуминият е тривалентен и има степен на окисление +3. Запишете и това.
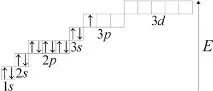
Помислете за структурата на алуминиевия атом:
1s 2 2s 2 2p 6 3s 2 3p 1 3d 0
В най-простата си форма алуминият е сребристо-бял метал. Принадлежи към леките и стопими, има висока електропроводимост и топлопроводимост. Във въздуха алуминиевите продукти са покрити с тънък оксиден филм. Точката на топене на този метал е 659 ° C, а плътността е 2,7 g / cm 3.
Алуминият е един от най-активните метали; той е силен редуциращ агент.
Глава I. Свойства на алуминия
За първи път този метал е получен чрез редуциране на неговия хлорид с метален калий или натрий без достъп на въздух:
AlCl3 + 3Na = Al + 3NaCl.
В промишлеността алуминият се получава чрез електролиза на разтвор на алуминиев оксид (технически Al2O3) в стопилка от криолит Na3AlF6 с добавяне на CaF2. Криолитът се използва катоалуминиев разтворител, а добавянето на калциев флуорид ви позволява да поддържате точката на топене в електролитната баня не по-висока от 1000°C.
1.2. Химични свойства
1. Алуминият лесно се окислява от атмосферния кислород, като е покрит със силен защитен филм от алуминиев оксид Al2O3. Подобна реакция възниква при изгаряне на горещ алуминий в чист кислород:
4Al + 3O2 2Al2O3.
Можем да наблюдаваме тази реакция при изгаряне на бенгалски огън.
2. Ако филмът от алуминиев оксид се разруши, тогава този метал активно ще взаимодейства с вода при нормална температура:
3. Лишен от оксиден филм, алуминият лесно се разтваря в основи с образуването на алуминати:
4. Лишен от оксиден филм, алуминият лесно се разтваря в разредени киселини с отделяне на водород:
5. Силно разредената и концентрирана азотна киселина пасивира алуминия, така че алуминиевите контейнери се използват за съхранение и транспортиране на азотна киселина. Но при нагряване алуминият се разтваря в азотна киселина:
6. Алуминият взаимодейства с халогени:
2Al + 3Br2 2AlBr3.
7. При високи температури алуминият взаимодейства с други неметали (сяра, азот, въглерод):
2Al + 3S Al2S3 (алуминиев сулфид),
2Al + N2 2AlN (алуминиев нитрид),
4Al + 3C Al4C3 (алуминиев карбид).
Реакциите протичат с отделяне на голямо количество топлина.
8. Алуминият се характеризира с алуминотермични реакции - редукцията на металите от техните оксиди от алуминий.
Алуминотермията се използва за получаване на редки метали, които образуват силна връзка с кислорода: ниобий Nb, тантал Ta, молибден Mo, волфрам W и др.
2Al + 3WO3 3W + Al2O3.
Нарича се смес от фин прах Al и магнитна желязна руда Fe3O4термит, при запалване се отделя голямо количество топлина и температурата на сместа се повишава до 3500 ° C. Този процес се използва при термитно заваряване:
8Al + 3Fe3O4 9Fe + 4Al2O3.