Анализ на ефекта на електролитите върху омокрянето и якостта на неконсолидирана глина
За разлика от уплътнената глина, порите в неуплътнената глина са със значителни размери, в които заедно с водата могат да проникнат както хидратирани йони, така и полимерни макромолекули. В зависимост от вида на електролитите, резултатите от взаимодействието на йони, проникнали в порите на глината, могат да бъдат различни. Както беше отбелязано по-горе, всички електролити могат да бъдат разделени на три групи: алкални, киселинни и неутрални.
Когато алкални електролити (ниска концентрация) взаимодействат с глинени частици, последните се активират (вижте част 1,
SiOH+NaOH ® SiO - +H2O+Na +,
в резултат на това обемната енергия на глината се увеличава, "абсорбцията" на вода се увеличава, влажността се увеличава и пластичната якост на глината намалява.
С увеличаване на концентрацията на алкали броят на катионите в разтвора се увеличава, плътността на ефузивния слой се увеличава и при
При определена критична концентрация на електролита глинените частици постепенно се дезактивират, в резултат на което дебелината на хидратния слой вода около частиците намалява, съдържанието на влага в глината намалява и нейната пластична якост на глината се увеличава.
Степента на хидратация и дехидратация за различните алкални електролити с повишаване на тяхната концентрация е различна. Зависи от хидрофилността на катионите, силата на тяхното взаимодействие с анионите на разтвора и разтворимостта на електролитите.
На фиг. 10.1. показва графика на зависимостта на хидратация и дехидратация на проби от неуплътнена глина, поставени в разтвори на различни алкални електролити (тази и следващите графики се основават на експерименталните материали на В. Д. Городнов)
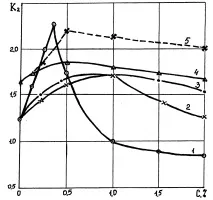
Най-активната хидратация се получава, когато NaOH, KOH, Ba (OH) 2 се въвеждат в разтвора на алкали, по-малко активно (поради по-ниската концентрация на хидроксилни групи в разтвора) за алкални соли и напълно неактивно за слабо разтворими Ca (OH) 2 бази.
Активността на дехидратацията зависи от плътността и активността на катионите в дифузния слой около глинестите частици, концентрацията и активността на електролитните аниони. В разтвори на алкални соли по време на хидролиза се образува значително количество доста активни аниони HPO4 2-, H2PO4 -, HCO3 - и др., Които намаляват активността на катионите.
В разтвори на силно разтворими алкали (например разтвори на NaOH с разтворимост 108 g на 100 ml вода) след хидратиране на частиците концентрацията на катиони нараства бързо и дехидратацията на глинените частици протича интензивно.
В разтвори на по-малко разтворими алкали Ba (OH) 2 (с разтворимост от 39 грама на 100 ml вода) количеството на катиони в разтвора е много по-малко. Да, и катионите са по-хидрофилни и по-малко мобилни. Следователно, въпреки високата валентност на катионите, неутрализирането на глинестите частици е по-слабо, зоната на дехидратация е значително разтегната.
Когато неалкалните електролити взаимодействат с глинени частици, хидратацията на частиците не е възможна; дори при ниска концентрация на електролит, в резултат на неутрализиране на потенциала на глинените частици, се наблюдава тяхната дехидратация.
Активността на взаимодействието на катиони с глинени частици в съответствие с изследванията на K.K. Gedroits (вижте част 1, параграф 4.4.) зависи от тяхната валентност и йонен радиус. За почви, почви (включително глинести), поради малкия йонен радиус, най-високата активностпоказва водороден йон H +, а най-силният неалкален електролит са киселини, които активно неутрализират потенциала на частиците, интензивно понижавайки съдържанието на влага в глината.
Както показват експерименталните изследвания, с помощта на киселини е възможно да се намали влажността на глината до K2 = 0,3, което поради хидрофилността на други катиони не може да бъде постигнато. На фиг.10.2. Показана е зависимостта на съдържанието на влага в глинести проби в разтвор на солна киселина от нейната концентрация. За разлика от действието на алкалните електролити върху глинените частици, вместо хидратация наблюдаваме дехидратация на частиците.
Поради неутрализирането на заряда на глинестите частици при концентрация на киселина до 0,3%, съдържанието на влага в глината намалява (до K2 = 0,3), а при по-нататъшно увеличаване на концентрацията в разтвора се появява излишък от Cl + аниони (тъй като част от катионите се адсорбира от глинести частици), което образува
вторият слой от глинени частици DEL. Налице е тяхното постепенно активиране и хидратиране до нормалната влажност на глината.
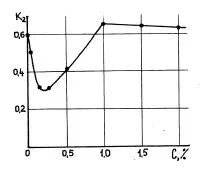
Фиг.10.2. Зависимост на влажността на глинести проби в разтвор на солна киселина от нейната концентрация
Разтворите на неутрални електролити при ниски концентрации не предизвикват екстремни стойности на увеличение или намаляване на съдържанието на влага в глината. Започвайки от нулева концентрация, с увеличаване на концентрацията, те постепенно намаляват съдържанието на влага в глината до определена граница, характерна за даден разтвор. Поради хидрофилността на катионите е невъзможно да се намали съдържанието на влага в глината до нула. Интензивността на намаляване на влажността на глината зависи от заряда, хидрофилността или глинофилността на катионите и активността на електролитните аниони. Скоростта на намаляване на влажността на глината с увеличаване на концентрацията на електролити също зависи от степента на тяхната дисоциация. При ниска концентрация, в съответствие със закона на Оствалд, степентаелектролитната дисоциация е по-висока, така че скоростта на намаляване на влажността на глината е по-висока, отколкото при по-висока концентрация на електролит.
От фигура 10.3. може да се види, че интензивността на намаляване на влагата в разтвор на по-хидрофилен електролит NaCl (1) е много по-малка, отколкото в разтвор на по-малко хидрофилен електролит KC1 (2), и много ниска интензивност на намаляване на влагата за електролити с много активни аниони
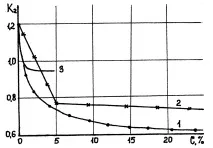
Ориз. 10.3. Зависимостта на съдържанието на влага в глинестите проби в разтвора на електролити на едновалентни метални соли от концентрацията на последните: 1 - NaCl; 2 - KCl; 3 - Na2SO4
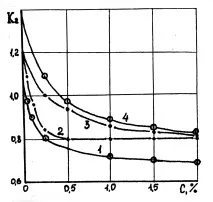
Ориз. 10.4. Зависимостта на съдържанието на влага в глинести проби в разтвор на неалкални електролити на поливалентни метали от концентрацията на последните: 1-CaCl2; 2-CaSO4; 3-BaCl2; 4-KAlSO4.
Същото може да се наблюдава и при електролити с поливалентни катиони (фиг. 10.4).
Силата на глинените скали е в пряка зависимост от тяхното съдържание на влага. Глинените частици, както беше отбелязано, са свързани помежду си с водни филми. Силата на филмите зависи от енергията на междумолекулно взаимодействие (U) на всяка водна молекула с глинени частици.
Глинените частици на скалата са разположени на сравнително малко разстояние една от друга и всяка водна молекула взаимодейства едновременно не с една (както в сондажната течност), а с редица близки глинести частици. Енергията на взаимодействие на водните молекули с тези частици може да се определи чрез сумиране на енергиите на взаимодействия на водна молекула с всяка частица поотделно, например чрез интегриране.
Приблизително изчисление при предположението за адитивност (сумиране) на енергията на междумолекулните взаимодействия, както беше отбелязано по-горе, беше извършено от Boer и Hamaker [6, 9].
Да се изведе енергийното уравнениемеждумолекулно привличане, беше използвано уравнението на енергията на привличане на една молекула към повърхността на адсорбента (в този случай глинени частици):
(10.1)
където С е константа, зависеща от природата на взаимодействащите молекули, n е броят на частиците; h е разстоянието от водна молекула до глинести частици (дебелина на водния филм).
В резултат на това, след интегриране на Boer и Hamaker, те получават формулата
, (10.2)
където A е константата на Хамакер, която е приблизително 10 -19 J.
Специфичната сила на взаимодействие на водните молекули с повърхността на глинените частици (силата на филма), съответно, ще бъде равна на
, (10.3)
където Co е постоянна стойност.
С увеличаване на съдържанието на влага в глината, дебелината на филма се увеличава, а неговата здравина и здравината на глината като цяло намаляват.
Съдържанието на влага в глината може да се изрази с формулата
, (10.4)
където Vв - количеството вода, погълнато от глината; S е общата повърхност на глинестите частици, m е броят на частиците, h е дебелината на водния филм. Оттук
, (10.5)
Замествайки стойностите на h във формула (10.3), получаваме
, (10.6)
тези. силата на глината е обратно пропорционална на нейното съдържание на влага в куба.
Съотношението на якост на глинена проба с различно съдържание на влага може да бъде записано като
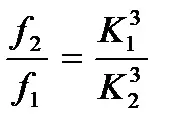
и якостта на проба с всякаква влажностfi
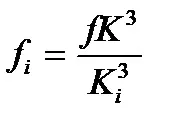
къдетоfе първоначалната якост на глинената проба; K е първоначалното съдържание на влага в пробата, Ki е съдържанието на влага в пробата, наситена с вода.
Експерименталните данни потвърждават получените изчисления (Таблица 10.1).
Силата на "сухите" уплътнени скали с много тънки водни филми (h) в много случаи не е по-ниска от здравината на други седиментни скали: варовици, пясъчници. С увеличаване на дебелината на хидратния филм, междумолекулнатавзаимодействието между частиците рязко намалява, а пластичната якост на глината също намалява (фиг. 10.5). Силата на хидратирания филм бързо нараства с намаляване на дебелината. На самата повърхност на частицата силата на взаимодействие на водните молекули достига хиляди kg / cm 2 (вижте част 1, 3.3). С отдалечаване от частицата тези сили намаляват обратно пропорционално на разстоянието на седма степен.
Таблица 10.1
Зависимост на пластичната якост на глинен образец от влажността K2