Анализ на уравнението на Михаелис-Ментен
1. Ако концентрацията на субстрата в реакцията е ниска, т.е. [S]>gt; Ks, тогава стойността на K може да бъде пренебрегната
където Vbiochem.r. = Vmax е уравнението от нулев ред.
Уравнението на Михаелис-Ментен е трансформирано от Лайнуивър и Бърк, използвайки метода на двойните реципрочни величини: ако има равенство между две величини, тогава реципрочните величини също са равни:
1/V = (1/V) / (KS + [S]) / [S] – уравнение на Михаелис-Ментен.
е уравнението на Лайнуивър-Бърк.
Уравнението на Михаелис-Ментен, където KS = K-1 / K + 1, е ограничено, тъй като взема предвид само първия период на процеса
и не отчита второто
Той е валиден само за кратки периоди на действие на ензима, когато има излишък от субстрат и нисък добив на реакционния продукт.
D. Haldane и D. Briggs за механизма E + S ↔ ES ↔ E + P
изведе подобреното уравнение на Михаелис-Ментен:
,
където Km = K-1 + K+2 / K+1 е константата на Михаелис.
Константата на Михаелис Km е важна характеристика на ензима, която определя неговия афинитет към субстрат:
Тъй като Ks = K-1 / K+1, тогава Km > Ks, със стойността на K+2 / K+1. Константата на Михаелис се изразява в молове на литър (mol/l).
Физическото значение на константата на Михаелис
Ако V = 1/2V, тогава Кm = [S]. Константата на Михаелис е равна на концентрацията на субстрата (S), при която се наблюдава скорост на реакцията, равна на 1/2 от максималната скорост (mol/l).
5.4. Методи за графично определяне на константата на Михаелис
Графичното представяне на константата на Михаелис изглежда така:
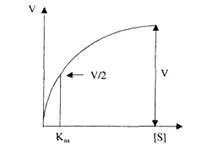
На графиката концентрацията на субстрата е нанесена по абсцисната ос, скоростта на реакция V е нанесена по ординатната ос, като V е максималната скорост, а V / 2 е половината от максималната скорост. Разрез по остаабциса - Km.
Освен това се използва графичен метод за определяне на константата на Михаелис по метода на двойните реципрочни величини на Лайнуивър и Бърк.
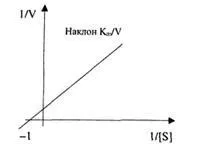
Уравнението на Lineweaver-Burk е:
Това уравнение е показано на графиката с права линия y = ax + b. 1/[S] се нанася по абсцисната ос, 1/Vпо ординатната ос.
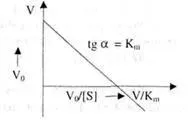
Можете също така да определите стойността на константата на Михаелис, като използвате диаграмата на Eady-Hofsti:
Количествена характеристика на ензимната активност
Понастоящем се използват две единици за ензимна активност: стандартната единица U (или единица за активност) и катал.
Единицата за активност U на ензима е неговото количество, което при определени условия катализира превръщането на 1 µmol от субстрата за 1 min или, ако се атакува повече от една връзка в молекулата на субстрата, 1 µeq (група) за 1 min.
Catal (cat) е каталитичната активност на ензим, който увеличава скоростта на реакцията с 1 mol/s в определена тестова система.
И в двата случая условията са строго определени, т.е. температура, pH, концентрация на субстрата.
Специфичната активност на ензима се определя чрез разделяне на броя на единиците ензимна активност на масата на протеина или тъканта (в g или mg).
Моларната активност на ензима се определя чрез разделяне на броя на единиците ензимна активност в пробата на масата на ензима, изразена в микромола (за пречистени ензими):
;