Биохимия на мускулната тъкан
Биохимия на мускулната тъкан B. 250599
МУСКУЛНА БИОХИМИЯ
Мускулната тъкан съставлява 40% от телесното тегло на човек. Биохимичните процеси, протичащи в мускулите, оказват голямо влияние върху цялото човешко тяло.
МУСКУЛНА ФУНКЦИЯ - МЕХАНИЧНО ДВИЖЕНИЕ, при което химическата енергия се преобразува в механична при постоянно налягане и постоянна температура. Никой изкуствен механизъм не е способен на това.
Функционална единица - САРКОМЕР.

Състои се от миозинови протеинови молекули. МИОЗИНЪТ е голям олигомерен протеин с молекулно тегло 500 kDa, състоящ се от 6 субединици, идентични по двойки.
Тежка верига: в С-края - алфа спирала, в N-края - глобула. При свързване на две тежки вериги с С-терминални участъци се образува супернамотка. Две леки вериги са част от глобулата (главата). Сърцевината на суперспиралата има 2 секции, където спиралите са голи - тези места са отворени за действието на протеолитичните ензими и имат повишена подвижност.
1. При физиологични условия (оптимално рН, температура, концентрации на соли), молекулите на миозина спонтанно взаимодействат една с друга с техните пръчковидни участъци („от край до край“, „от страна до страна“), използвайки слаби видове връзки. Само пръчките взаимодействат, главите остават свободни.
2. Молекулата на миозина има ензимна активност (АТФазна активност: ATP+H2O----->ADP+P). Активните центрове са разположени върху главите на миозина.
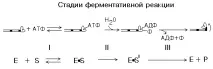
1-ви етап. Сорбция на субстрата. По време на този етап АТФ се фиксира върху мястото на адсорбция на активния център на миозиновата глава.
2-ри етап. хидролиза на АТФ. Възниква на каталитичното място на активния център на главата. Продуктите на хидролизата (ADP и F) остават фиксирани, а освободената енергия се натрупвав главата.
Забележка: Чистият миозин in vitro има АТФазна активност, но е много ниска.
3-ти етап. Миозинът е способен да взаимодейства с актина на тънките нишки. Прикрепването на актин към миозина повишава АТФазната активност на миозина, в резултат на което скоростта на хидролиза на АТФ се увеличава 200 пъти. Това е третият етап на катализа, който се ускорява. Освобождаване на реакционни продукти (ADP и P) от активния център на миозиновата глава.
Забележка: Чистият миозин има ензимна активност, но е много ниска.
3. Миозинът със своите глави може да взаимодейства с актин (актин-контрактилен протеин), който е част от тънки нишки.
Прикрепването на актин към миозина незабавно повишава АТФазната активност на миозина (повече от 200 пъти). Актинът е алостеричен активатор на миозина.
Тънките нишки са съставени от три протеина:
- контрактилен протеинактин
- регулаторен протеинтропомиозин
- регулаторен протеинтропонин
ACTIN е малък глобуларен протеин, молекулното му тегло е 42 kDa. G-актинът е глобула. При физиологични условия неговите молекули са способни на спонтанна агрегация, образувайки F-актин.
Съставът на тънката нишка включва две F-актинови нишки, образува се суперспирала (2 усукани нишки). В областта на Z-линиите актинът е прикрепен към a-актинин.
МЕХАНИЗЪМ НА МУСКУЛНАТА КОНТРАКЦИЯ.
1. Афинитетът на комплекса "миозин-АТФ" към актина е много нисък.
2. Афинитетът на комплекса "миозин-АДФ" към актина е много висок.
3. Актинът ускорява разцепването на ADP и F от миозина и в същото време настъпва конформационно пренареждане - въртене на главата на миозина.
1-ви етап 2-ри етап 3-ти етап 4-ти етап
1-ви етап. Фиксиране на АТФ върху миозиновата глава.
2-ри етап.хидролиза на АТФ. Продуктите на хидролизата (ADP и F) остават фиксирани, а освободената енергия се натрупва в главата. Мускулът е готов за контракция.
3-ти етап. Образуване на актин-миозиновия комплекс. Той е много издръжлив. Той може да бъде унищожен само чрез сорбция на нова молекула АТФ.
4-ти етап Конформационни промени в миозиновата молекула, водещи дозавъртане на миозиновата глава. Освобождаване на реакционни продукти (ADP и P) от активния център на миозиновата глава.
Миозиновите глави "работят" на цикли, като перките на рибата или греблата на лодката, поради което този процес се нарича "механизъм на греблото" на мускулна контракция.
Изследователят Györgyi е първият, който изолира чист актин и миозин. In vitro се създават необходимите физиологични условия, при които се наблюдава спонтанно образуване на дебели и тънки нишки, след което се добавя АТФ - в епруветката се получава мускулна контракция.
РЕГУЛИРАНЕ НА МУСКУЛНАТА КОНТРАКЦИЯ
Фибриларен протеин, молекулно тегло - 70 kDa. Има формата на а-спирала. В една тънка нишка има 7 молекули G-актин на молекула тропомиозин. Тропомиозинът се намира в жлеба между двете спирали на G-актина. Свързва тропомиозина "от край до край", веригата е непрекъсната. Молекулата на тропомиозина затваря активните места на свързване на актина на повърхността на актиновите глобули.
Глобуларен протеин с молекулно тегло 80 kDa има 3 субединици: тропонин "Т", тропонин "С" и тропонин "I". Той е разположен върху тропомиозина с равни интервали, чиято дължина е равна на дължината на молекулата на тропомиозина.
Тропонин Т (TnT) - отговаря за свързването на тропонина с тропомиозина, чрез тропонин "Т" конформационните промени в тропонина се предават на тропомиозина.
Тропонин С (TnC) - Ca 2+ -свързваща субединица, съдържа 4 места засвързващ калций, структурно подобен на протеина калмодулин.
Тропонин I (TnI), инхибиторна субединица, не е истински инхибитор - той само създава пространствена пречка, която пречи на взаимодействието на актин и миозин във време, когато тропонин "С" не е свързан с Ca 2+.
РЕГУЛИРАНЕ НА СЪКРИВАНЕТО И ОТПУСКАНЕТО НА МУСКУЛИТЕ В ЖИВАТА КЛЕТКА
1. Мускулното свиване започва с нервен импулс. Под въздействието на ацетилхолина се развива възбуждане на клетъчната мембрана и нейната пропускливост за Ca 2+ рязко се увеличава.
2. Ca 2+ навлиза в цитоплазмата на мускулната клетка (саркоплазма) от депо – цистерни на цитоплазмения ретикулум. Концентрацията на Ca 2+ в саркоплазмата мигновено нараства 100 пъти (от 10 -7 М до 10 -5 М).
3. Калцият се свързва с тропонин "С". Това води до конформационни промени в молекулата на тропонина, в резултат на което пространствената пречка под формата на тропонин "I" се елиминира, в резултат на конформационни промени в тропонин "Т", молекулата на тропомиозина се изтегля настрани и отваря миозин-свързващи центрове на повърхността на актина. По-нататъшното свиване на мускулите следва модела (вижте предишната фигура на страница 3).
За да настъпи мускулна релаксация, са необходими следните условия:
1. Освобождаването на тропонин "C" от Ca 2+ - за това работи мембранно свързаният ензим Ca 2+ -зависима АТФаза. Този ензим използва енергията на хидролизата на АТФ, за да пренесе Ca 2+ обратно в резервоарите срещу техния концентрационен градиент. За натрупването на калциеви йони в резервоарите помага протеинът КАЛСЕКВЕСТРИН. Калсеквестрин - свързва Ca 2+ в цистерни. Когато мускулът е готов да се свие, концентрацията на Ca 2+ в цистерните е висока.
Не само процесът на свиване, но и процесът на отпускане се нуждае от АТФ, защото ако няма АТФ, тогава Ca не работи.2+ -зависима АТФаза. При тези условия калцият е свързан с тропонин "С" - цялата система е в активно състояние, няма разпад на актомиозиновия комплекс - мускулът е постоянно в състояние на съкращаване. Тази ситуация се наблюдава след смъртта на човек в състояние на "rigor mortis".
Запасите от АТФ в клетката са значителни, но те са достатъчни, за да осигурят мускулна работа само за 0,1 секунда. Но в мускулната клетка има много бърз ресинтез на АТФ.
Характеристика на мускулната тъкан е много бързите промени в концентрацията на АТФ (100 или повече пъти).
МЕХАНИЗМИ НА ЕНЕРГИЙНО СНАБДЯВАНЕ НА МУСКУЛНАТА РАБОТА
1. Специални реакции на субстратно фосфорилиране.
2. Гликолиза, гликогенолиза.
3. Окислително фосфорилиране.
1. Специални реакции на субстратно фосфорилиране
Участието на специални реакции на субстратно фосфорилиране в осигуряването на енергия на мускулната клетка е различно - зависи от интензивността, продължителността, мощността и продължителността на мускулната работа.
1)Креатинфосфокиназна реакция.
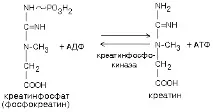
Това е най-бързият начин за ресинтез на АТФ. Резервите от креатин фосфат са достатъчни, за да осигурят мускулна работа за 20 секунди.
Най-ефективният. Не изисква наличието на кислород, не произвежда нежелани странични продукти, включва се моментално. Недостатъкът му е малък резерв от субстрат (достатъчно само за 20 секунди работа). Обратната реакция може да протече в митохондриите, като се използва АТФ, образуван по време на окислителното фосфорилиране.
Митохондриалната мембрана е силно пропусклива както за креатин, така и за креатин фосфат, а креатин фосфокиназата присъства както в саркоплазмата, така и в междумембранното пространство на митохондриите.
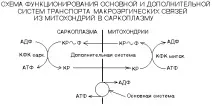
2)Миокиназна реакция. Работи само вмускулна тъкан!
Реакцията се катализира от миокиназа (аденилат киназа).
Основното значение на тази реакция е образуването на AMP, мощен алостеричен активатор на ключовите ензими на гликолизата, гликогенолизата и пътя на GBF.
2. Гликолиза, гликогенолиза.
Не изискват наличието на кислород (анаеробни процеси). Имат голям резерв от субстрати. Използват се мускулен гликоген (2% от мускулното тегло) и кръвна глюкоза, получена от чернодробен гликоген.
1) Ниска ефективност: 3 ATP на един глюкозен остатък от гликоген.
2) Натрупване на недоокислени продукти (лактат).
3) Гликолизата не започва веднага - само 10-15 секунди след началото на мускулната работа.
3. Окислително фосфорилиране.
1. Това е най-енергийно изгодният процес - при окислението на една молекула глюкоза се синтезират 38 молекули АТФ.
2. Има най-голям резерв от субстрати: глюкоза, гликоген, глицерол, могат да се използват кетонови тела.
3. Продуктите от разлагането (CO2 и H2O) са практически безвредни.
Недостатък: изисква повишено количество кислород.
Важна роля в осигуряването на мускулната клетка с кислород играе миоглобинът, който има афинитет към кислорода, по-голям от този на хемоглобина: при парциално налягане на кислорода, равно на 30 mm Hg, миоглобинът е наситен с кислород със 100%, а хемоглобинът е само 30%. Следователно миоглобинът ефективно отнема кислорода, който доставя от хемоглобина.
ПРОМЕНИ В МЕТАБОЛИЗМА ПО ВРЕМЕ НА МУСКУЛНА РАБОТА.
1. Намаляването на концентрацията на АТФ измества равновесието на креатинфосфокиназната реакция надясно: използва се креатин фосфат. След това се включва гликолизата, така че системата за окислително фосфорилиране се нуждае от 1 минута, за да започне. Това е началната фаза на мускулната работа.
2. Следващметаболитните промени зависят от интензивността на мускулната работа:
а) ако мускулната работа е продължителна и с ниска интензивност, тогава в бъдеще клетката получава енергия чрез окислително фосфорилиране - това еработа в "аеробната зона";
б) ако мускулната работа е с подмаксимална интензивност, тогава - в допълнение към окислителното фосфорилиране се активира гликолиза - това е най-трудната мускулна работа - възниква „кислороден дълг", това еработа "в смесената зона";
в) ако мускулната работа е с максимална интензивност, но кратка, тогава механизмът на окислителното фосфорилиране няма време да се включи. Работата се дължи единствено на гликолизата. След края на максималното натоварване лактатът навлиза от кръвта в черния дроб, където протичат реакции на глюконеогенеза, или лактатът се превръща в пируват, който се окислява допълнително в митохондриите (GDP път). Окислението на пируват изисква кислород, следователно след мускулна работа с максимална и субмаксимална интензивност, потреблението на кислород от мускулните клетки се увеличава -кислородният дълг (дълг) се връща.
По този начин енергийното снабдяване на различните видове мускулна работа е различно. Следователно има специализация на мускулите и осигуряването на енергия за различните мускулни клетки е коренно различно: има "червени" мускули и "бели" мускули.
Червени мускули- „бавни” окислителни мускули. Имат добро кръвоснабдяване, много митохондрии, висока активност на ензимите за окислително фосфорилиране. Проектиран за аеробни операции. Например, такива мускули служат за поддържане на тялото в определена позиция (поза, поза).
Бели мускули- „бързи“, гликолитични. Имат много гликоген, лошо кръвоснабдени, високоактивност на гликолизни ензими, креатинфосфокиназа, миокиназа. Те осигуряват максимална мощност, но краткотрайна.
Човек няма специализирани мускули, но има специализирани влакна: има повече "бели" влакна в разтегателните мускули, повече "червени" влакна в мускулите на гърба.
Съществува наследствено предразположение към мускулна работа - някои хора имат повече "бързи" мускулни влакна - препоръчва им се да се занимават с тези спортове, при които мускулната работа е с максимална интензивност, но краткосрочна (вдигане на тежести, спринт и др.). Хората, които имат повече "червени" ("бавни") мускулни влакна в мускулите си, постигат най-голям успех в онези спортове, които изискват продължителна мускулна работа със средна интензивност, например маратонско бягане (дистанция 40 км). За да се определи пригодността на дадено лице за определен вид мускулно натоварване, се използва иглена биопсия на мускулите.
В резултат на високоскоростни тренировки (културизъм) миофибрилите се сгъстяват, кръвоснабдяването се увеличава, но непропорционално на увеличаването на масата на мускулните влакна, количеството актин и миозин се увеличава и активността на гликолизата и креатинфосфокиназните ензими се увеличава.
По-полезно за тялото обучение "издръжливост". В същото време мускулната маса не се увеличава, но се увеличава количеството на миоглобина, митохондриите и активността на ензимите на GBF пътя.