Цел, Платформа за съдържание
ELISA комплект ACTH е предназначен за количествено определяне на ACTH (адренокортикотропен хормон) в човешка плазма. Заинвитродиагностика.
DRG Intl ACTH ELISA [ензимно-свързан имуносорбентен анализ] за измерване на биологично активен ACTH (верига от 39 аминокиселини). Овче поликлонално антитяло срещу човешки ACTH, пречистено чрез афинитетна хроматография, и мише моноклонално антитяло срещу човешки ACTH са специфични за добре дефинирани региони на молекулата на ACTH. Едно антитяло се свързва само към С-края на ACTH 34-39 и се биотинизира. Другото антитяло се свързва само със средните участъци и N-края на ACTH 1-24 и се маркира с пероксидаза от хрян за откриване.
По време на анализа, калибратори, контроли и проби от пациенти се инкубират едновременно с ензимно белязано антитяло и биотинизирано антитяло в покрити със стрептавидин ямки. След инкубиране, микроямките се промиват, за да се отстранят несвързаните компоненти и свързаният с твърда фаза ензим се инкубира с TMB (тетраметилбензидин) субстрат. Реакцията се спира чрез добавяне на стопиращ разтвор на киселинна основа и цветът на съдържанието на ямките се променя. Интензитетът на жълтия цвят е право пропорционален на концентрацията на ACTH в пробата. Кривата на зависимостта на концентрацията от единиците за абсорбция се изгражда според резултатите, получени при измерване на калибратори. Концентрациите на оригиналните ACTH контроли и проби от пациенти се определят от тази крива.
биотинизирано анти-ACTH антитяло (афинитетно пречистено овче анти-ACTH антитяло)
антитела срещу ACTH, белязани с пероксидаза от хрян (миши моноклонални антитела срещу ACTH)
измиващ концентрат (физиологичен разтвор с повърхностно активно вещество)
един държач с покрити лентистрептавидин
12 ленти с 8 дупки
лиофилизиран (с изключение на нулев калибратор) синтетичен
h-ACTH. Калибратор за нула (разтвор на BSA/конски серум) в течна форма, готов за употреба. Всички други калибратори се състоят от синтетичен ACTH (1-39) в разтвор на BSA/конски серум
Забележка: Точните концентрации могат да бъдат намерени на етикетите на флаконите
лиофилизиран. 2 нива. Синтетичен h-ACTH (1-39) в разтвор на BSA/конски серум
Забележка: Точният диапазон е върху етикетите на флакона
1 x 2 ml на ниво
Допълнителни задължителни артикули:
• добра пералня [ако не е налична, ръчното пране е приемливо]
• прецизни пипети за 25, 100 и 150 µL.
•(по избор): многоканална пипета50, 100 и 150 µL.
Предупреждения и предпазни мерки за потребителите:
Реагентите на комплекта не съдържат човешки кръвни компоненти. Пробите от пациенти, които може да са положителни за хепатит B повърхностен антиген, HBcAg или HIV антитела, трябва да се третират като потенциално биологично опасни. Трябва да се спазват обичайните предпазни мерки при работа с нетествани проби.
Стоп разтворът се състои от 1 N сярна киселина. Това е силна киселина. Работете внимателно, за да избегнете изгаряния (използвайте ръкавици и предпазни очила). В случай на разливане, незабавно изплакнете обилно с вода. Да не се вдишват изпарения!
Вземане и съхранение на проби.
Определянето на ACTH трябва да се извърши с помощта на плазмена EDTA. Сдвоените проби изискват 400 µl E DTA плазма. Съберете цяла кръв в лавандулова (EDTA) епруветка. Трябва да бъдат правилно разделениплазма, за предпочитане в охладена центрофуга. Съхранявайте при -20°C или по-ниска. Серумните проби могат да се съхраняват до 8 часа при 2-8°C. Плазмените проби EDTA (-20°C) са стабилни до 4 месеца.
Подготовка и съхранение на реагента.
1. Съхранявайте всички компоненти на комплекта при 2-8°C с изключение на промивния концентрат и стоп разтвора при получаване преди употреба.
Всички реагенти с изключение на ненулевите калибратори, контролите и промивния концентрат са готови за употреба.
Съхранявайте всички реактиви при 2-8°C, с изключение на промивния концентрат, който трябва да се съхранява на стайна температура до разреждане, за да се избегне утаяване.
2. За всеки ненулев калибратор (калибратори B - F) и контроли 1 и 2, разтворете всеки флакон чрез добавяне на 2 ml дестилирана и дейонизирана вода и разбъркайте. Оставете да престои 10 минути, след което разбъркайте добре до пълно възстановяване.Използвайте калибратори и контроли веднага след разтваряне. Замразете останалите калибратори и контроли (-20oC) възможно най-скоро след употреба. Стандартите и контролите са стабилни при -20°C 6
седмици след възстановяване. Допускат се до 3 размразявания, при условие че с реагентите се борави съгласно инструкциите в параграф "Бележки за анализа".
3. Реагент A: Промивен концентрат: Разбъркайте добре флакона. Ако има утайка в измивния концентрат поради дългосрочно съхранение при ниски температури, напр. 4 ° C, разтворете утайката във водна баня при 37 ° C или в пещ при непрекъснато разбъркване. Добавете към промивния концентрат (30 ml дестилирана или дейонизирана вода и разбъркайте. Разреденият работен промивен разтвор е стабилен за 90 дни пристайна температура.
1. Поставете в държача броя ямки със стрептавидин, необходими за използване на всички (6) ACTH калибратори, ACTH калибратори A - F [точните концентрации са посочени на етикета на флакона], контролни плазми, проби от пациенти.
2. Разпределете 200 µl проби в маркираните ямки. Замразете (-20°C) останалите калибратори и контроли възможно най-скоро след употреба.
3. Добавете 25 µl от реагент 1 (биотинизирано антитяло) към всяка ямка за проба.
4. Добавете 25 µl от реагент 2 (ензимно белязано антитяло) към същите ямки. Покрийте блюдото с алуминиево фолио или табла, за да предотвратите светлина, поставете в орбитален шейкър (170 +10 rpm) за 4 часа + 30 минути при стайна температура (22°-28°C).
5. Първо аспирирайте течността, след това измийте всяка ямка 5 пъти с работен промивен разтвор (приготвен от реагент А) с помощта на промивна машина за кладенци. Отстранете остатъчната влага, като поставите таблетката върху абсорбиращ материал. Обемът на промивния разтвор трябва да е достатъчен за използване на 0,35 ml на ямка.
6. Добавете 150 µl от реагент B (TMB субстрат) към всяка ямка.
7. Избягвайте излагането на светлина, поставете плочите в орбитален шейкър при 170 + 10 rpm за 30 + 5 минути при стайна температура. (22°-28°C).
8. Добавете 100 µl стоп разтвор към всяка ямка. Разбъркайте внимателно.
9. Отчетете абсорбцията на разтвора в ямките в продължение на 10 минути, като използвате четец за микроплаки, настроен на 450 nm срещу 250 µl дестилирана или дейонизирана вода. Прочетете отново ямките при 405 nm срещу дестилирана или дейонизирана вода.
Забележка:второто четене е предназначено за разширяванекрива на калибриране до стойността на максималния калибратор, прибл. 500 pg/mL. Следователно, стойностите на пробите от пациенти с ACTH > 150 pg/mL могат да бъдат определени от калибрационна крива, начертана от показанията до концентрация, еквивалентна на максималното показание на калибратора при 405 nm,без да се взема предвидмаксималната дължина на вълната на абсорбция.
Пробите и контролите трябва да се четат при 450 nm за концентрации на ACTH до 150 pg/mL. Концентрациите на ACTH над 150 pg/mL трябва да се интерполират при отчитане при 405 nm.
10. Като използвате крайните стойности на абсорбция, получени в предишната стъпка, изградете калибровъчна крива, като използвате кубичния сплайн, 4-параметърния логистичен метод или метода на интерполация точка по точка, за да изчислите концентрацията на ACTH.
Бележки за анализ.
• ACTH 1-39 е силно нестабилна молекула. Тестването трябва да се извърши веднага след разтваряне или размразяване на всички калибратори, контроли и проби от пациенти.
• Пробите трябва да се пипетират в ямки без въздушни мехурчета. За това
използвайте "обратна пипета" според инструкциите на производителя на пипетата.
• Проби от пациенти със стойности над максималния калибратор ( F ), прибл. 500 pg/mL (точната концентрация е посочена на етикета на флакона), може да се разреди с Калибратор A (нула) и да се тества отново. Умножете резултата по фактора на разреждане.
• Не използвайте реактиви от различни партиди.
• Ако е необходимо, смесете равни обеми за анализ от реагенти 1 (биотинирано антитяло) и 2 (ензимно белязано антитяло) в чист жълт флакон, след което добавете 50 µL от смесеното антитяло към всяка ямка. Тезистъпките заместват стъпки (3) и (4), последвани от инкубиране в орбитален шейкър.
Проучване на блок-схема

1. От отчитането на 450 nm начертайте калибрационна крива, като използвате първите пет калибратора: калибратори A, B, C, D и E.
От показанията при 405 nm изградете втора калибрационна крива, като използвате трите калибратора с най-високи концентрации, т.е. калибратори D, E и F.
2. Задайте концентрацията, посочена на флакона, към всеки калибратор в pg/mL. Начертайте данните от калибровъчната крива върху милиметрова хартия с концентрацията на оста x и съответната абсорбция на оста y.
3. Свържете две съседни точки с права линия. Този математически алгоритъм се нарича точково изчисление.
Концентрацията на пробата може да се получи чрез нанасяне на стойността на абсорбцията върху оста Y и намиране на съответната концентрация по оста X.
Пробите от пациентите и контролите трябва да се четат при 450 nm за концентрации на ПТХ до 200 pg/mL. Концентрации на ПТХ над 150 pg/mL трябва да се интерполират, като се използват показания при 405 nm.
Могат да се използват и компютърни програми, използващи кубичен сплайн или 4 PL [4 - Parameter Logistics].
(Данни за проби от пациенти при 450 nm (отчитания на абсорбцията спрямо дестилирана или дейонизирана вода))

Тъй като концентрацията > 150 pg/mL, препоръчително е да използвате данните, получени при 405 nm, вижте таблицата по-долу Примерни данни при 405 nm.
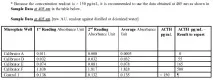
За проби с резултати от pg / ml се препоръчва да се използват данни, получени при
дължина на вълната 450 nm, вижте колоната "Данни за проба при 450 nm" в таблицата. Това ще гарантира оптимални резултатизадайте чувствителност.
Данните са предоставени само за илюстративни цели и не трябва да се използват като заместител на данни от изследвания.

контролната плазма трябва да се тества с всеки тест на калибратори и проби от пациенти.
Резултатите от изследването на контролните проби за приемливост трябва да бъдат оценени с помощта на подходящи статистически методи. Ако резултатите от контролните проби са извън допустимия диапазон по време на изследването, резултатите от пробите на пациентите може да са невалидни.
Комплектът PTH ELISA не показа „ефект на закачане на висока доза“ при тестване на проби с 20 000 pg/mL ACTH. Пробите с нива на ACTH над максималния калибратор трябва да бъдат разредени и тествани отново.
Нивата на ACTH са измерени при 83 пациенти (САЩ) с помощта на комплекта Sangui ACTH ELISA. Получените стойности варират от 7,9 до 66,1 pg/mL. Средна геометрична стойност + 2 стандартни отклонения на средната стойност = 8,3 до 57,8 pg/mL.

Анализирани са 117 проби от пациенти, като нивата на ACTH варират от 1,5 до 1045 pg/mL чрез DRG ELISA и Nichols IRMA ACTH комплект за имунорадиометричен анализ. Получават се следните статистически данни (линейна регресия):

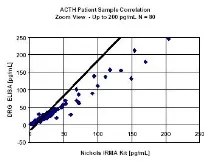
или минималното откриваемо ниво на даден набор се определя от най-малката единична стойност,
не е равно на нула, с доверителна граница от 95%. Чувствителност DRG ACTH ELISA = 0,46 pg/mL.
Прецизност и възпроизводимост.
Прецизността (вариация в рамките на анализа) на комплекта DRG Intl ACTH ELISA беше изчислена от определянето на 21 повторения на всяка от двете проби.
Цялостна прецизност (Вариация между анализите) DRG Intl ACTH ELISA комплектизчислено от две проби, получени от 35 различни изследвания, от трима специалисти с три различни партиди реактиви за период от 9 седмици.
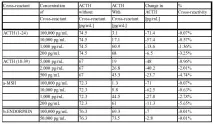
Специфичност и кръстосана реактивност
Кръстосаната реактивност на ACTH е изследвана чрез добавяне на различни вещества към стандарта ACTH:
Различни количества ACTH бяха добавени към плазмата на четирима пациенти:
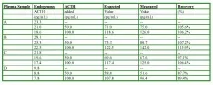
По време на изследването на кинетичния ефект не е забелязано значително изместване на данните:

Линейност на разрежданията на проби от пациенти: Паралелизъм
5 плазмени проби на пациенти бяха разредени с калибратор А (нула). Резултати в pg/mL: