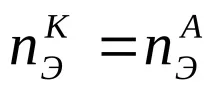Електрохимични процеси
Електрохимичните процеси са процеси на взаимно преобразуване на химически и химични форми на енергия.
Според посоката на взаимното преобразуване на електрически и химични форми на енергия се разграничават две групи електрохимични системи:галванични клетки, в които се извършва спонтанното преобразуване на енергията на химическа реакция в електрическа енергия, иелектролизатори,в които поради външна електрическа енергия протичат електрохимични реакции върху електродите.
Електрохимичната система обикновено се състои от външна верига (метални проводници, измервателни устройства, консуматор) и вътрешна верига, която включва два електрода и йонен проводник между тях.
Електродите могат да бъдат от метални или полупроводникови материали. Йонният проводник е разтвор на електролит, неговата стопилка или твърд електролит.
Основната особеност на електрохимичните реакции е, че свързаните процеси на окисление и редукция в тях са пространствено разделени и протичат на различни електроди. Електродът, върху който протичат окислителните процеси, се нарича анод. Електродът, върху който протичат редукционните процеси, се нарича катод.
ОСНОВНИ ПОНЯТИЯ. ЕЛЕКТРОДНИ ПОТЕНЦИАЛИ. ЗАКОНИТЕ НА ФАРАДЕЙ.
Един от най-важните елементи на вътрешната верига е интерфейсът електрод-йон проводник. На тази граница се появява така нареченият двоен електрически слой (виж фигурата), характеризиращ се със сложно взаимодействие на метала с компонентите на разтвора, което води до потенциален скок, който се наричаелектроден потенциал. Големината на този потенциален скок зависи от естеството на електрода, състава на електролита и температурата. Абсолютната стойност на потенциала на електрода не може да бъде определена, но може да бъде измеренапотенциална разлика между два електрода. Такъв електроден потенциал обикновено се обозначава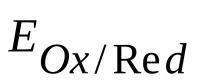
Ox+n
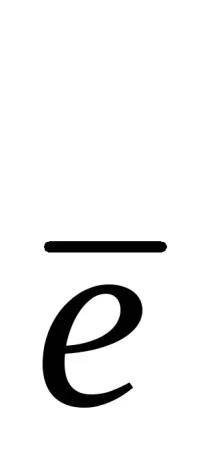
Потенциалът на електрода при липса на ток във веригата при равновесие на потенциалоопределящата реакция се наричаравновесиеи се означава с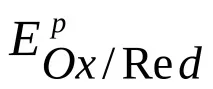
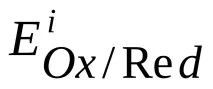
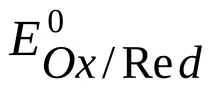
В електрохимията общоприета е скалата на водородния потенциал, при която потенциалът на стандартен водороден електрод при 298 K се приема за нула;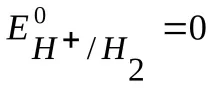
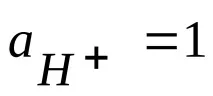
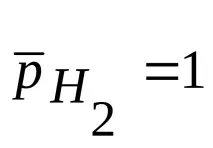
Реакцията, определяща потенциала на такъв електрод, е реакцията
2Н + (р) + 217>18Н2, (1.2).
Стойностите на стандартните електродни потенциали във водни разтвори при 298 K, определени по водородната скала, са представени в таблица 1 на приложението.
Стойностите на равновесните потенциали за условия, различни от стандартните, се изчисляват съгласноуравнението на Нернст,което в общия случай за потенциалоопределящата реакция (1.1) има формата:
, (1.3)
където –Rе универсалната газова константа, 8,31J/mol.K;n– броят на електроните, участващи в реакцията (равен на броя молеквиваленти на мол вещество);F– число на Фарадей, 96500 C/mol-eq (26,8 A h/mol-eq);T– температура, K.
Има 3 различни вида електроди: 1) метални (метали в разтвор на собствени йони); 2) газ (на основата на Pt в електролитен разтвор, през който се пропуска съответният газ); 3) редокс (инертен електрод в разтвор, съдържащ окислени и редуцирани форми в йонна форма - редокс електроди).
За метални електроди потенциалоопределящата реакция е:
M(p) n + +n
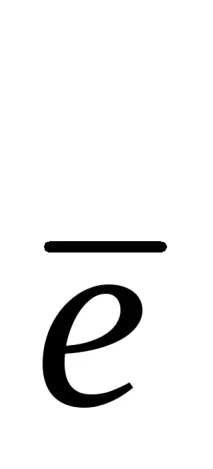
Уравнението на Нернст за изчисляване на потенциала на метален електрод, тъй като активността на твърдата фаза се приема равна на единица, има формата:
, (1.4).
За 298 K, преминавайки към десетичния логаритъм, имаме
, (1,4 а);
За водороден електрод, потенциалоопределящата реакция (1.2), уравнението на Нернст е написано като:
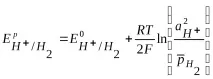
Тъй като, както е посочено по-горе,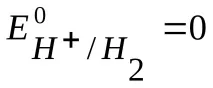
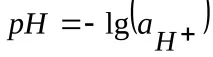
, (1.5a).
Газовият кислороден електрод е Pt-електрод, върху който се извършва реакция, определяща потенциала
O2+ 424+ 2H2O25OH -, (1.6).
Уравнението на Нернст за такъв електрод се записва като:
, (1.7).
Стандартният потенциал на кислородния електрод, имаме удобен израз за изчисляване на потенциала на кислородния електрод:
, (1.7a).
Законите на Фарадей.Количествено електрохимичните трансформации на веществата се подчиняват на два закона на Фарадей:
1) масата или количеството на веществото, което е претърпяло трансформация на електрода при протичане на постоянен ток, е пряко пропорционалноколичеството преминала електроенергия;
2) когато едно и също количество електричество преминава през различни електролити, масите на различните вещества, участващи в електродните реакции, са пропорционални на моларните маси на техните еквиваленти. От това следва, че за електрохимичната трансформация на 1 мол еквивалент от вещество е необходимо същото количество електричествоF,наречено число на Фарадей.
И двата закона могат да се комбинират със следните изрази:
- за масата на веществото:
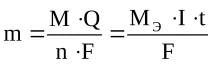
- за обема на газообразните вещества:
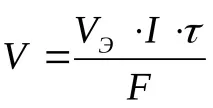
къдетоME–е моларната маса на еквивалента на веществото, g/mol,
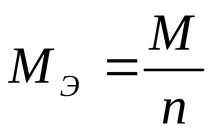
VE–обем мол-еквивалент газ, l/mol;
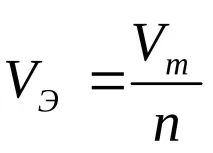
Q- количеството електроенергия, преминало през системата, C,
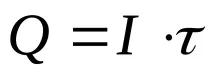
(При нормални условия (n.o.) 1 мол от всеки газ заема обем
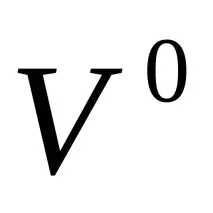
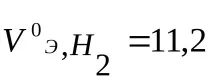
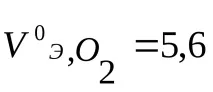
Броят молеквиваленти на веществата, които са претърпели електрохимични трансформации на катода и анода, изразени в молеквиваленти, са равни един на друг