Електропроводимост на течни диелектрици
При течните диелектрици се наблюдават предимно йонна и електрофоретична проводимост. В областта на силни електрически полета към тези видове проводимост се добавя електронен компонент.
Йонна проводимост
Йонната проводимост се дължи на дрейфа - насоченото движение на положителни и отрицателни йони под действието на приложено електрическо поле и разреждането им при електродите. Йоните се образуват в резултат на електролитна дисоциация (разпад) на йонни вещества (йонни примеси) под действието на полярни молекули на средата (разтворител). Йонният примес между атоми (йони) има химическа връзка: йонна (например NaCl) или ковалентна, силно полярна (например H2O).
Ако примесът има йонна връзка (например NaCl), тогава механизмът на електролитна дисоциация изглежда като този, показан на фиг. 3.6. Полярните молекули на разтворителя (външната среда) се привличат от йони, разположени във възлите на кристалната решетка, ориентират се близо до тези йони и на свой ред ги привличат към себе си. Привличайки към себе си йоните на решетката, молекулите на разтворителя отслабват връзката между тях, в резултат на което йоните се отделят от решетката и преминават в разтворителя. Йоните, преминаващи в разтворителя, остават свързани с неговите полярни молекули.
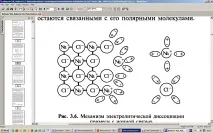
Ориз. 3.6. Механизмът на електролитна дисоциация на примес с йонна връзка
Ако примесът се състои от полярни молекули, тогава полярните молекули на разтворителя (средата) са ориентирани около дисоциираната молекула и отслабват ковалентната връзка между нейните атоми (фиг. 3.7). В резултат на това молекулата се разлага на йони, които остават свързани с молекулите на полярния разтворител.
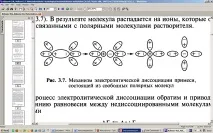
Ориз. 3.7. Механизъм на електролитна дисоциация на примес, състоящ се от свободни полярни молекули
Процесът на електролитна дисоциация е обратим и води до състояние на равновесие между недисоциираните молекули и йони
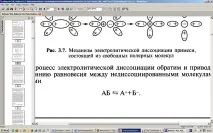
Електролитната дисоциация възниква в отсъствието на електрическо поле и нейната величина - степента на дисоциация - зависи от следните фактори:
1) полярност () на дисоциираната молекула,
2) полярност () среда,
Колкото по-голяма е полярността на дисоциираните молекули, полярността на средата и колкото по-висока е температурата, толкова по-голяма е степента на електролитна дисоциация и, следователно, толкова по-висока е концентрацията на йони и толкова по-ниско е съпротивлението на диелектрика.
В течните неполярни диелектрици йоните могат да се образуват по два начина: в резултат на електролитна дисоциация на йонен примес (например вода), който е влязъл в диелектрика по време на неговото производство и работа, а също и в резултат на електролитна дисоциация на свободни органични киселини и вода - продукти на термоокислително разграждане (стареене) на самото вещество. В течните полярни диелектрици йоните се образуват и поради дисоциацията на техните собствени полярни молекули.
Електрофоретична проводимост
Електрофоретичната проводимост се дължи на дрейфа (насоченото движение) на колоидните частици и част от йоните на дифузионния слой и тяхното разреждане при електродите.
Пример за колоидни системи в електротехниката са:
Емулсии (и двата компонента са течности);
Суспензии (твърди частици в течност);
Аерозоли (твърди и течни частици в газ).
Когато се приложи поле, колоидните частици започват да се движат, което се проявява като феномен на електрофореза. Електрофорезата се различава от електролизата по това, че по време на нея не се наблюдава образуване на нови вещества, а се променя само относителната концентрация на дисперсната фаза в различните слоеве.течности.
Електрофоретична електрическа проводимост се наблюдава по-специално в масла, съдържащи емулгирана вода и в органични течности, съдържащи смоли.