Електропроводимост
Електролитите в разтвора се дисоциират на катиони и аниони. В много разредени разтвори на силни електролити се наблюдава почти пълна дисоциация, докато степента на дисоциация на слабите електролити се определя от стойността на константата на дисоциация на солта, киселината или основата, а степента на дисоциация на последните две зависи и от рН на разтвора. Наличието на йони определя електрическата проводимост на водните разтвори.
Дефиницията на електрическата проводимост (L) се свежда до дефиницията на реципрочната стойност - съпротивление R, т.е. .
Стойността на L се изразява в реципрочни омове или Сименс (cm). Съвременните кондуктометри ви позволяват директно да измервате стойността на електрическата проводимост (ϰ) в S/cm или S/m.
Специфичната електрическа проводимост е електрическата проводимост на колона от разтвор, разположена между два електрода с повърхност 1 cm 2, разстоянието между които е 1 cm . Специфичната електрическа проводимост зависи от температурата на разтвора и при определена температура от неговия състав, т.е. от концентрацията или по-точно от активността на различни катиони и аниони. Следователно електрическата проводимост характеризира общата стойност на йонния състав на водата. В питейната вода, както и в повечето повърхностни води, съдържащи предимно неорганични вещества, електропроводимостта е приблизителен показател за концентрацията на неорганични електролити, т.е. характеризира общата минерализация на водата. В отпадъчни води, съдържащи соли на органични киселини или основи, ϰ е приблизителен индикатор за концентрацията на органични и неорганични електролити.
Влиянието на физичните свойства на водната проба, като нейната плътност и вискозитет, върху стойността на електропроводимостта в повечето случаи е незначително.
Определяне на минерализацията по стойностспецифична електрическа проводимост е най-подходящо да се извърши за същия тип повърхностни или отпадъчни води, т.к. за да се намери минерализация чрез електрическа проводимост, последният, както всеки друг физичен параметър, трябва да бъде калибриран чрез стойността на минерализацията, определена с друг метод.
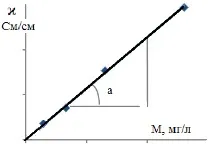
Полученият коефициент на преобразуване (Ctg a), по който трябва да се умножи ϰ, за да се получи стойността на минерализация, не е постоянен за води с различен качествен състав. Поради това най-надеждни резултати могат да се получат само за води с един и същи състав, за които също е извършено калибриране. Като цяло стойностите на минерализацията, изчислени от електрическата проводимост, могат да се разглеждат само като приблизителни.
Независимо от това, стойността на ϰ е важна експресна информация и спомагателен индикатор за качеството на водата.
Определянето на стойността на ϰ също е незаменима техника за изследване на хетерогенността на химичния състав на водите, дължаща се на притока на притоци, изхвърлянето на замърсени отпадъчни води и др.
При анализ на вода специфичната електрическа проводимост се определя при 20 ° C. Пробите не могат да бъдат консервирани. Препоръчва се определянето да се извърши не по-късно от 1 ден след избора на халата. Замърсяването на електродите също влияе върху резултата от измерването на проводимостта, особено при определяне в отпадъчни води,, съдържащи повърхностно активни вещества: мазнини, смоли, масла и др. Резултатите от измерването в такива случаи са съмнителни. В края на измерването замърсените електроди трябва да се измият първо с подходящ разтвор на разтворител, избран според вида на замърсяването, след това с алкохол или разтвор на синтетичен детергент и накрая да се измият обилно с дестилирана вода.
Алкалност
- Силни основи, които напълно се дисоциират в разтвори, за да образуват хидроксидни йони (KOH, NaOH);
- Слаби основи (амоняк, анилин);
- Аниони на слаби киселини (HCO3 -, CO3 2-, H2PO4 -, HPO4 2-, HS -, S 2-, аниони на хуминови киселини и др.). Анионите на слабите киселини се хидролизират до образуване на хидроксидни йони:
HCO3 - + H2O H2CO3 + OH -,
Следователно те, като истински основи, определят алкалността на водата.
В обикновените природни води алкалността зависи по правило само от бикарбонатите на алкалоземните метали. В този случай pH стойността на водата не надвишава 8,3.
Наличието на разтворими карбонати и хидроксиди повишава pH до повече от 8,3. Тази част от общата алкалност, която съответства на количеството киселина, необходимо за понижаване на pH до 8,3, се нарича свободна алкалност на водата (n).
Алкалността се определя чрез титруване на водата със силен киселинен разтвор. Количеството разтвор, използвано за достигане на pH 8,3, е еквивалентно на свободна алкалност; количеството, необходимо за достигане на pH от 4,5, е еквивалентно на общата алкалност. Ако pH на водата е по-малко от 4,5, тогава нейната алкалност е нула.
Крайната точка може да се намери визуално с помощта на индикатори, които променят цвета си при рН 4,5 (метилоранж) и 8,3 (фенолфталеин) или електрометрично. Електрометричното титруване се препоръчва при анализ на по-замърсени води.
Алкалността, особено свободната алкалност, трябва да се определи веднага след вземането на пробата. Ако това не е възможно, тогава вземете пълната бутилка и определете алкалността не по-късно от 24 часа.Резултатите от определянето се изразяват в mmol / l еквиваленти.
Поради факта, че общата и свободната алкалност са в стехиометрична зависимост от съдържанието на HCO3 -, CO3 2- йони, по отношение наnиtможе да се определи индиректно от присъствието и количеството на тези йони. Изчислението се основава на предположението, че анионите на други слаби киселини не допринасят значително за общата алкалност.
При титруване с киселина до pH 8,3, т.е. при определяне на свободната алкалност присъстващите в разтвора карбонати се титруват само наполовина, т.е. към бикарбонати, следователно концентрацията на CO3 2- в mol / l е равна на:
къдетоnе свободната алкалност в mol/l еквиваленти.
Киселинност
Основната консумация изразява общата киселинност на водата(p).
В обикновените природни води киселинността в повечето случаи зависи само от съдържанието на свободен разтворен въглероден диоксид. Естествената част от киселинността може да се създаде и от хуминови и други слаби органични киселини. Във всички тези случаи pH на водата обикновено не пада под 4,5.
Някои промишлени отпадъчни води често съдържат големи количества силни свободни киселини или техните киселинни соли. Тези вещества нарушават баланса на свободния CO2 и карбонатите. В специални случаи, например в минна вода или в отпадъчни води от декапиране на метали, соли на силни киселини и слаби основи (предимно желязо и алуминий), обикновено силно хидролизирани, често се срещат в големи количества. Във всички тези случаи pH на водата може да бъде под 4,5. Тази част от общата киселинност, която намалява рН до 4,5 и по-ниско, се нарича свободна киселинност на водата.
Киселинността на водата се определя чрез титруване със силна основа. Количеството титруван разтвор, използван за получаване на pH 4,5, съответства на свободната киселинност;количеството, изразходвано за получаване на pH 8,3, съответства на общата киселинност(p).киселинността е нула. Краят на титруването се определя визуално или електрометрично. Електрометричното определяне е по-удобно за анализ на замърсени отпадъчни води.
За точно определяне на киселинността се препоръчва да се извърши определяне на място. Ако това не е възможно, тогава пробата се взема в специална колба с вместимост най-малко 0,5 l, оборудвана със запушалка. Пробите се вземат с помощта на дюза, която предотвратява контакта на пробата с атмосферния въздух. Напълнената до горе колба се затваря с шлифована тапа, като се изместват всички въздушни мехурчета от бутилката. По време на транспортиране бутилката е защитена от нагряване. Пробата се анализира не по-късно от един ден.
Общата киселинност(p)и свободната киселинност се изразяват в mol/l еквиваленти.
къдетоpе общата киселинност в mol/l еквиваленти на веществото.
Ако pH на водата падне под 4,5, тогава в такава вода има свободни силни киселини и резултатът от определянето на общата киселинност в такива води не може да се използва за изчисляване на съдържанието на свободен CO2.
Твърдост
Общата твърдост на водата показва концентрацията на двувалентни алкалоземни метални катиони в нея, предимно калций и магнезий, така че се изчислява чрез сумиране на нормалните концентрации на тези два йона. Тези елементи влизат във водата в естествени условия поради ефекта на въглеродния диоксид върху карбонатните минерали или в резултат на биохимични процеси, протичащи във влажни слоеве на почвата. Твърдостта на естествените води може да се промени по време на пречистване във водопроводи или когато отпадъчните води се изхвърлят в тях.
Твърдостта в нашата страна традиционно се измерва в mmol / l еквиваленти, но от 2005 г., в съответствие с въведения GOST, твърдостта се изразява в степени на твърдост (o F). 1 околоW съответства на 1 mmol/l еквиваленти на алкалоземни метали (Ca 2+ и Mg 2+).
Според степента на обща твърдост природните води се делят на:
| Много мек | на) |
| Мек | 1,5 - 4 |
| Умерено твърд | 4 - 8 |
| Твърд | 8 - 12 |
| Много трудно | > 12 |
Количеството калций и магнезий, еквивалентно на количеството карбонати и бикарбонати, се нарича карбонатна твърдост.
Некарбонатната твърдост се определя като разликата между общата и карбонатната твърдост и показва количеството катиони на алкалоземни метали, съответстващи на аниони на минерални киселини: хлоридни, сулфатни, нитратни йони и др.
И така, карбонатната твърдост често е равна на количеството бикарбонати и карбонати във водата, т.е. обща алкалност.
Например водата съдържа 4,52 mmol/L калциеви еквиваленти, 1,64 mmol/L магнезиеви еквиваленти и 5,05 mmol/L бикарбонати. В този случай общата твърдост е 4,52 + 1,64 = 6,16 mmol / l еквиваленти, карбонат = 5,05, некарбонат = 1,11 mmol / l еквиваленти.
Отстранимата твърдост, както и карбонатната твърдост, се дължи на наличието на бикарбонатен йон във водата. Но за разлика от карбонатната твърдост, която е изчислена стойност, отстранимата твърдост е експериментална стойност, показваща колко намалява общата твърдост след продължително кипене на пробата поради реакциите, протичащи по време на това:
Изглежда, че подвижната твърдост е равна на карбонатната. Въпреки това, полученият калциев карбонат и особено магнезиевият карбонат имат известна разтворимост, в резултат на което определено количество CO3 2- йони и еквивалентно количество Ca йони остават в разтвора.2+ и Mg 2+. Следователно отстранимата твърдост, макар и близка по величина до карбонатната, все още е малко по-малка от нея. Отстранимата твърдост се определя експериментално от разликата между алкалността на водата преди кипене и алкалността на същата проба от предварително преварена вода.
Общата твърдост се определя в питейни, подземни и повърхностни води, а в специални случаи и в отпадъчни води. Общата твърдост се определя чрез комплексонометрично титруване с натриев етилендиаминтетраацетат.
Високата твърдост влошава органолептичните свойства на водата, придава й горчив вкус и засяга храносмилателните органи. Следователно стойността на общата твърдост в източниците на централизирано водоснабдяване е разрешена до 7 mmol / l еквиваленти (o W).
Познаването на твърдостта на водата е важно не само за определяне на възможността за използване на водата, но и за оценка на състоянието на екосистемите. Така че твърдата вода смекчава токсичния ефект на замърсителите върху хидробионтите. В по-мека вода при същата концентрация на токсиканти токсичният им ефект ще бъде по-силен.