Ембрионални стволови клетки
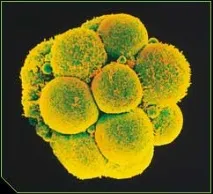
ГЛАВА 1 Ембрионални стволови клетки: Основни изследвания
1. На прага на новата биология и медицина
2. ESC: основни дефиниции и концепция
3. Основните източници и методи за изолиране на ESC (исторически контекст)
4. Молекулярна основа на тотипотентността на ESC генома
5. Характеристики на ESC фенотипа
6.ESC е модел за изучаване на геномиката на ранната ембриогенеза и органогенезата
7. Насочена диференциация на ESCs и PPCinvitro
8.ESCs в изследването на функциите на Hox гена
9.ESC - нов биоресурс на медицината
10.ESC: законодателство и биоетика
11. Мост между науката и клиниката
Глава 2 Стволови клетки в ембриогенезата на мозъка на бозайници
1.Модели в пресечната точка на клетъчната биология и геномиката
2.Невралната тръба е основният източник на временни стволови клетки
3.Стволово пространство на обонятелния невроепител
4.Епендимално пространство на стъблото
5.Клонална дисперсия на мозъчни стволови клетки
6.Регионализация и сегментация на невралната тръба
7.Първична невро- и глиогенеза
8.Насочвана миграция на прогениторни клетки: взаимодействие с радиална глия
9.In vitro невронни стволови клетки
10.Методологични трудности при получаване на NSC клонове от ESCs
11.Получаване на неврони от ESCs
12.Вземете NSC линии
13. Трансплантация на NSC/прогениторни клетки в развиващия се мозък на ембриони
14.Трансдиференциация на NSC след трансплантация
15.Невромезенхимни стволови клетки от нервния гребен
Ембрионални стволови клетки: основни изследвания
Естествените сили в нас са най-добрите лечители на болести
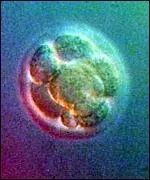
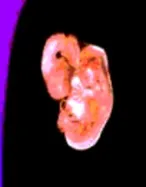
1. На прага на нова биология и медицина
Удивителното разнообразие от многоклетъчни организми има много скромно начало в едно оплодено яйце. Много поколения биолози и ембриолози са размишлявали върху мистерията как генетичната информация на една клетка е макроразмерена в стотици милиони клетки в нов ембрион.
Експерименталният напредък беше възпрепятстван от факта, че яйцата, зиготите и бластомерите не могат да бъдат прехвърлени в безсмъртни линии, като по този начин се получава клетъчен материал в количества, достатъчни за изследване на спектрите на иРНК и протеини (Weismann, 2000). Само ембрионалните стволови клетки (ESC) - пролифериращите "двойници" на зиготата - са се превърнали в нов ресурс за клетки, които са в началото на развитието. Науката е направила първата стъпка към лабораторна тъкан, репликираща соматичната ембриогенеза на бозайници, заобикаляйки гаметите и оплождането.Тотипотентносттае свойството на клетъчния геном към програми за ембриогенеза в макромащаб, включително възпроизвеждане на която и да е от 250-те специализирани клетки на възрастен организъм. Подобно на зиготата и първите клетки на ембриона, ESC при прости условия на култура възпроизвеждат "лабораторна" ембриогенеза на два етапа. Първо, микрограмови количества от "клетки без фенотип" преминават в милиарди клетки. Незрелите постмитотични клетки след това се мутират в мозъка, сърцето, скелетните мускули, черния дроб и други подобни с помощта на набора от химични инструкцииinvitro. Получаването на соматични клетки от ESC заобикаля органогенезата и многосъбития, които се случват по време на естественото развитие на ембриона в матката. Както е известно, специализираните клетки на възрастен организъм необратимо губят способността си да повтарят ембриогенезата. В културата повечето специализирани клетки, изолирани от тъкани, бързо се дедиференцират, губейки своя фенотип и функционален профил. Науката все още не знае как да получи стволови клетки от диференцирани клетки. ESC е ембриогенеза без зародишни клетки и бременност.
ESCs са незаменим модел за функционална постгеномика. Кардиомиоцитите, миоцитите, кръвните клетки и имунната система са пълни автомати. Поведението на ESC се определя от взаимодействието на външни сигнали с епигеномната система от клетки с уникална протеомика и огромно меню от предварително синтезирани иРНК. На ESC клетки с най-простия фенотип е по-лесно да се анализира основният алгоритъм на онтогенезата: как меките сигнали непрекъснато променят твърдата структура на клетките. За разлика от молекулярната генетика, която изучава функциите на отделните гени, постгеномиката се занимава с протеомиката на интегралните протеинови мрежи (как меките мрежи сглобяват клетъчни устройства). Интегрални протеинови мрежи - платформа за целенасочено клетъчно поведение под формата на алтернативни отговори. Адекватният избор на сигнали и ESC реакции ни принуждават да признаем, че клетките имат елементарен интелект за разпознаване, селекция на сигнали и тяхната селективна обработка. Селективният подбор на сигнали се превежда допълнително в модели на клетъчно поведение. Поведението на клетката и нейното разрушаване е крайната цел на съвременната медицина. Това ниво на познание предоставя нови инструменти за разкриване на клетъчни заболявания и стареене.
Друга важна характеристика на генома на ESC е, че скоростта на спонтанна мутация е няколко пъти по-ниска от тази на соматичните клетки. интрахромозомна рекомбинация иендорупликацията на отделни сегменти от хромозоми е напълно блокирана от хроматиновото устройство. Генетичната нестабилност на хромозомите и анеуплоидията в пасажите са типични само за линиите на тератокарцином и ембриокарцином (Servantes R.B., Stringer J.R., Tischfield JA, 2002). Тази характеристика на организацията на хроматина прави малко вероятни произволни хромозомни пренареждания, свързани със злокачествено заболяване на трансплантирани ESC производни.
Стволова ниша -стабилна микросреда около всеки ESC клон, създаден от монослой от така наречените захранващи клетки. Трофобластът служи като хранилка за ембриобласта в предимплантационни ембриони на бозайници. Клетките на хороидния плексус служат като хранителна, защитна и информационна среда за невронните стволови клетки на епендимата на развиващия се мозък. Ендотелните синуси или капилярна мрежа служат като ниша за регионални стволови клетки на органи и тъкани, включително мезенхимни стволови клетки. Поради тази причина всички ранни ембрионални ESC се отглеждат в суспензия върху монослой от захранващи стромални клетки, които осигуряват на незрели плурипотентни клетки всичко необходимо за оцеляване и самообновяване.
Понастоящем ESC са необходими не само за дешифриране на кодовете на предимплантационното развитие, но и за лабораторно възпроизвеждане на органни клетки, заобикаляйки бременността. Получаването на миниоргани in vitro е по-трудна задача от получаването на диференцирани клетки от същите органи. Зиготните резервни клетки са от съществено значение за биоетично валидни експерименти. ESC не са ембрион, те нямат статут на "нов живот", тъй като са получени заобикаляйки оплождането и бременността. Поддържайки клетъчния ранг, ESC са нещо повече: те серийно възпроизвеждат органогенезата. Те са незаменими за изучаване на връзките на развитието на клетка/орган/тъкан. До наукатаима достатъчна платформа за окончателно определяне на правния / биоетичен статус на ранните ембриони, ембриони и фетуси. Липсата на законодателна рамка за всички периоди от човешкия живот оказва значително влияние върху приемането на практически решения в областта на репродуктивното и терапевтичното клониране. Биоетичните предпоставки на много високоразвити страни, които утвърждават статуса на нов живот и личност от момента на зачеването и появата на зигота, противоречат на приетото законодателство, което признава правата на нов живот само от момента на раждането. Съгласуването на тези въпроси на ниво държави и международни институции (ООН, Съвета на Европа и др.) е от първостепенно значение за свободното развитие на биологията и медицината. Както знаете, правата за нови изследвания и знания могат да бъдат ограничени, ако човекът или плодът не се превърнат в инструмент в ръцете на други хора.
Биолозите в съвременното общество са принудени да защитават правото на нови граници на знанието и новите технологии. Развитието на зигота в ембрион се възпроизвежда в лаборатория. Много религиозни представители настояват, че създаването / унищожаването на ранни ембриони в лабораторията е неприемливо. В същото време платеното донорство на яйцеклетки (1500-2000 щатски долара) е разрешено в САЩ и много страни, което отвори пътя за несексуално получаване на ранни ембриони. Една функционираща банка за сперматозоиди и яйцеклетки в Норфолк, Канада е в състояние да осигури на всички биотехнологични компании изкуствени бластоцисти за изолиране на ESC линии. Бластоцисти вече могат да бъдат получени чрез прехвърляне на ядрото на соматична клетка на клиент в зряла донорска яйцеклетка, от която преди това е бил отстранен пронуклеусът. Лабораторни банки от тотипотентни клетки вече са създали техногенна ембриология и алтернатива на половия процес, а не с цел повторениевъзпроизвеждане на копия на вече живи хора, но с цел лечение на милиони пациенти на планетата. Според прогнозата през 2020-2030 г. около една трета от пациентите ще получат лечение под формата на трансплантации на ESC производни. Не мисленето, а единствената възможна помощ за умиращия пациент е императивът на биоетиката до леглото на пациента (особено за тези, които са фатално обречени). Желанието за помощ води лекаря към лабораторното клониране на клетките на пациента като последно ефективно средство за помощ. В днешно време става неморално да не се използват ESC за създаване на банка от резервни клетки за всеки човек в случай на заболяване. Най-хуманната биоетика кара останалата част от обществото да вижда проблема предимно през очите и нуждите на болните хора и техните близки семейства. Всеки пациент има право на спасение и нови форми на лечение. Науката и обществото трябва да развият медицина, която дава нов шанс за оцеляване или удължаване на живота на поколенията, съществуващи на земята. Новите реалности на медицината значително промениха вектора на дискусиите около ESC.
През 14 век се водят ожесточени богословски спорове относно възможността за аутопсии след смъртта, за да се изследват вътрешните органи и причините за заболяванията. Само няколко лекари от онзи век се осмелиха да създадат зала за дисекции. Без тези пионери следващият век нямаше да има анатомичен атлас и великите открития на Леонардо. Морфологията става първата царица на медицината през 15 век. През 21-ви век, на кръстовището на ESC клетъчната биология с функционалната постгеномика, се ражда ново бъдеще на медицината през 21-ви век. Неизбежно се разгарят спорове и дискусии, а знанието обраства с митове и предразсъдъци в обществото.