Физични и химични свойства на водата
Водата (водороден оксид) е бинарно неорганично съединение с химична формула H2O. Молекулата на водата се състои от два водородни атома и един кислороден атом, които са свързани помежду си чрез ковалентна връзка. При стандартни условия е прозрачна течност, безцветна (в малък обем), мирис и вкус.
Молекулата на водата има ъглова форма. Според теорията на валентните връзки в молекулата на H2O две sp 3 хибридни орбитали на кислородния атом участват в образуването на две O-H връзки. Другите две sp 3 хибридни орбитали съдържат две несвързващи електронни двойки. Ъгълът на връзката на водата HOH е 104,5 °, дължината на връзката O-H е 0,0957 nm (фиг. 1.1):
Фигура 1.1 Водна молекула
Поради сравнително големия положителен заряд на ядрото на кислородния атом (8+) и близостта на неговите електрони, кислородният атом привлича електрони много по-силно (т.е. много по-електроотрицателни) от водородните атоми (1+). Това води до прехвърляне на заряд от водородните атоми към кислородния атом, а оттам и полярността на водната молекула.
Водата е единственото химично съединение, което може да съществува в природата едновременно в течно, твърдо и газообразно състояние. Много от неговите физически свойства и техните промени са аномални.
Основните причини за аномалните промени в свойствата на водата са полярността на нейните молекули и образуването на обемна система от структури с водородни връзки. Те правят водата силно реактивно съединение с уникално добра способност за разтваряне на полярни и йонни вещества, докато всички природни съединения се разтварят във вода.
Коефициентът на обемно разширение има отрицателни стойности при температури под 3,98°C, топлинният капацитет по време на топене почти се удвоява и в диапазона 0-100°Cпочти не зависи от температурата - има минимум при 35°C. Други аномални свойства на водата са аномално високи точки на кипене от 100°C и точки на топене от 0°C.
Вискозитетът на водата с нарастващо налягане намалява необичайно бързо в областта на ниските температури при нагряване (което не е характерно за други вещества). Всички аномални явления се дължат на особеностите на структурата на водните молекули и способността им да образуват молекулни агрегати и свързаните с тях молекули - (Н2О)n.
Масата на 1 ml пречистена речна вода се приема за единица маса и се нарича грам.
Точка на замръзване при 760 mmHg – 0°С; точка на кипене - 100°C.
Водородно свързване
Въпреки сравнително простата структура на молекулата, водата има широк спектър от уникални и специфични свойства. Една от причините за тези свойства е способността му да образува водородни връзки (фиг. 1.1). Водородна връзка възниква, когато водороден атом в молекула е свързан със силно електроотрицателен елемент, в нашия случай кислородът действа като такъв елемент. В същото време Водородът придобива частичен положителен заряд H δ+ - O δ- , което му позволява да привлече друга молекула, която също съдържа електроотрицателен елемент - Кислород. Така в образуването на водородна връзка винаги участват три атома - два електроотрицателни кислородни атома и разположеният между тях водороден атом O ∙∙∙ H δ+ – O δ-. Водородната връзка обикновено се означава с точки [5].
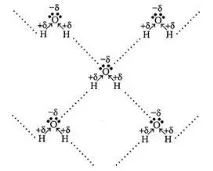
Фигура 1.1 Графично представяне на образуването на водородни връзки
Енергията на образуване на водородни връзки е ниска, но поради значителното им количество те значително влияят върху физикохимичните свойства на веществата, повишавайки техните точки на топене и кипене. Водата в своя атомен състав трябва да бъдегазообразно вещество и кипят при приблизително -80°C, а не при +100°C, имат точка на топене приблизително -100°C, а не 0°C [6].
Нека разгледаме по-подробно аномалиите, причинени от наличието на водородни връзки.
Точка на топене
В леда всички водни молекули образуват по четири водородни връзки (две като донори и две като акцептори) и остават относително неподвижни. По време на топенето някои от водородните връзки се разкъсват, което позволява на молекулите да се движат по-активно. По-голямата част от енергията, необходима за разкъсване на връзките, се прехвърля към системата по време на топенето и свободната енергия на Гибс (1.1) трябва да бъде равна на нула в точката на фазов преход.
∆H е промяната на енталпията,
∆S е промяната в ентропията,
С повишаване на температурата броят на водородните връзки в течната вода намалява и нейната ентропия се увеличава, но остава относително ниска поради високото ниво на структуриране. В този случай компонентът на енталпията трябва да бъде балансиран от члена на ентропията. По този начин чрез повишаване на температурата на топене се постига увеличаване на стойността на ентропийния член (-T∆S), което осигурява енергията, необходима за разкъсване на връзката. По този начин можем да заключим, че ниската ентропия (високото ниво на структуриране) на течната вода води до висока температура на топене [4].
Аномалия на плътността
Аномалията на плътността е двойна. Първо, след топенето на леда, плътността на водата се увеличава, преминава през максимум при 4°C и едва след това намалява с повишаване на температурата (фиг. 1.2). За почти всички други течности плътността намалява с повишаване на температурата. Това се обяснява с факта, че колкото по-висока е температурата, толкова по-висока е топлинната скорост на молекулите, толкова по-силно те се натискат една друга, което води до по-голямо разхлабване.структури. Разбира се, във водата също повишаването на температурата увеличава топлинната скорост на молекулите, но това води до намаляване на плътността само при високи температури [7].
Фигура 1.2 Зависимост на плътността на водата от температурата
Второ, плътността на водата е по-голяма от плътността на леда. Както знаем, по време на топенето плътността на течността се оказва по-малка от тази на кристала. Въпреки това, плътността на водата надвишава плътността на леда с 10%. За сравнение, помислете за метали, тяхната плътност намалява с 2 - 4% по време на топене. Това означава, че скокът на плътността по време на топенето на леда е аномален не само по знак, но и по величина. Обяснението на това явление е фактът, че по време на топенето на леда мрежите от водородни връзки са силно изкривени, ъглите започват да се отклоняват от тетраедричните и празнините между водните молекули намаляват.