ФЛУОРНИ СЪЕДИНЕНИЯ
Свободният флуор F2 е почти безцветен (леко зеленикаво-жълт) газ, имащ при нормални условия плътност от 1,696g / l.Точката на топене на флуора е -219,6 °, точката на кипене (при 760mm Hg),-188,1 °, критичната температура е -129 °, критичното налягане е 55at.Налягането на наситените пари на течния флуор в диапазона от -219,6°(1,7 mm Hg)до -183,7° (1220mm Hg)може да се изчисли по формулата:
Флуорът е най-електроотрицателният елемент. Потенциалът на нормален електрод за флуор е 2,85v.Флуорът е изключително реактивен и се свързва директно с всички елементи с изключение на инертни газове и азот. Поради образуването на плътен защитен филм от нелетлив флуорид, някои метали (желязо, мед, магнезий, никел) при липса на вода са много устойчиви на действието на флуора.
Флуорът реагира бурно с повечето химични съединения на други елементи, както и с почти всички органични вещества. Флуорът не взаимодейства с въглероден оксид и въглероден диоксид. Той разбива водата.
F2 + H20 = 2HF + 4.
Хлорен трифлуоридCIF3- при нормални условия, газ, който бавно се хидролизира от вода до образуване на HF, C12, 02, CIO2, C102F, C1F,CIO3F,количествата на които зависят от съотношението C1F3:H205-6.
Свойства на наситена параHF
Плътност на парите, g/l
Топлина на изпаряване,*Cal/mol
* Като се вземат предвид 6,15kcal/mol '.
асоциационен фактор; за ieassociated
Линия на средното молекулно тегло) и налягане и насищане (сочеща линия) на флуороводород.
Състояние, както и във водни разтвори на HF молекулатасвързани 8-9 (фиг. 313). За температури от O до 105° налягане на наситените пари (Таблица 86) HF (вmm Hg)Изчислено10 по формулата:
Флуороводородът HF е безцветен, кипи (при 760mm Hg)При 19,9°, топи се при -83,1°; критични точки7: температура 188 ±3°, налягане 66,2 ± 3,5kgf/cm2,плътност 0,29 ± 0,03g)cm3.
4 В газообразни, в течни
Фиг. 313.
В точката на кипене. Течен енергичен разтворител. Флуоридите на алкални метали и в по-малка степен флуориди на алкалоземни и други метали се разтварят добре в него. Водата, разтворена в нея, става силен електролит поради дисоциация по схемата
Плътността на течния флуороводород намалява почти линейно от 1.21g/cm3 при точката на топене до 0.0959 g/cm3 флуороводород е
Което, както при дисоциацията на други електролити в течен флуороводород, се основава на реакцията p:
Безводният флуороводород е по-силна киселина, отколкото във водни разтвори, дисоциацията в която следва същия модел (HF^H+ + F
+ HF ^ HF2)1Z- С флуоридите на алкални метали HF образува кристални съединения от типа MF-nHF; например за KF n = 2, 3 и 4 13.
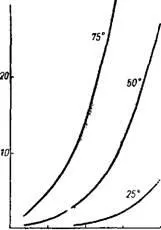
Фиг. 314. КонцентрацияHFInгазова фаза върху флуороводородна киселина.
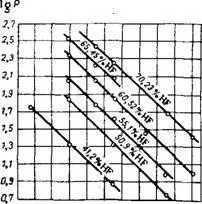
Фиг. 315. Парно наляганеHF(P, mmHg)Id с флуороводородна киселина с различни концентрации.
Флуороводородът е силно разтворим във вода; нейните водни разтвори се наричат флуороводородна или флуороводородна киселина. Равновесните концентрации на HF в газовата фаза върху флуороводородна киселина са показани на фиг. 314 14 и 315 15.
На налягането на парите на H20 в системата HF-H20 иналягане на HF и H20 в системата HF-H2SO4-H20, вижте 15>16.
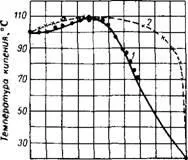
Температурите на замръзване на флуороводородна киселина са показани на фиг. 316 (в присъствието на примеси H2SO4 и H2SiF6 вижте Ref. 17). Точките на кипене в системата HF-H20 и равновесните състави на парите при атмосферно налягане са показани на фиг. 317. Тези данни се отнасят за разтвори на флуороводородна киселина, съдържащи 0,1-1,8%
H2SiF6. Както може да се види от диаграмата, в системата HF-H20 има азеотропна смес, съдържаща 37,5% HF и кипене при 109 ° (760mm Hg) 18.Според други източници19, съставите на азеотропните смеси и техните точки на боклук са: 43,2% HF и 111 ° или 35.4% HF и 120 °; такива несъответствия очевидно са причинени от трудността при пречистване на флуороводородна киселина от H2SiF6. Вероятно по-точен е съставът на азеотропна смес с концентрация на HF 38,26%, кипяща при 112° при налягане 750,2mm Hg. stL20. На фиг. 318 и 319 са дадени
0 20 40 60 80 100
Киселинните флуориди на алкални метали от типа MHF2 са по-слаби киселини от HF, докато съединенията на други метали, като A1F3 • 3HF или H3A1F6, са по-силни от HF. Натриевият бифлуорид NaHF2 има плътност 2,08g/cm3-,разтворимост във вода при €° 2,28%, при 40° 4,92% "Налягането на дисоциация на NaHF2 (вmm Hg)се определя по формулата22: lgP= -3830/7 + 9,97 или (inatза интервал 2 73-371°K) съгласно формулата23: 1nP =
\u003d -3940 / 7 + 6,677. NaF лесно абсорбира HF от разреден газ при 100° и го освобождава като концентриран HF при 250°. Калиевият бифлуорид KHF2 има плътност 2,35G/cm3,съществува в две форми с температура на преход от 195-196°. KHF2 дисоциационно налягане (вmmHg)Определено по формулата: lg P=-4000/7 + 8,574. Наситен воден разтвор съдържа при 00 - 18,63%, при 100 ° - 50,5% KHF2. В системата KF-Образуват се HF–H20 21 калиеви полихидрофлуориди KF • 4HF, KF-3HF, 2KF-5HF, KF-2HF, които са идентични на бинарните съединения в системата KF–HF
В системата NH4F-HF се образуват съединения NH3 • nHF, където n е 2, 3 и 424. За парциалното налягане на NH3 и HF в тази система вижте справка 25. На фиг. 320 показва изотермите на разтворимост в системата NH4F-NH4HF2-H20 2b. Евтоничен разтвор в системата NH4HF2-NH4C1-H20 при 25° съдържа 36,75% NH4HF2, 10,51%' NH4C1 и 52,74% H2027-28.
Когато HF реагира с S03 или HS03C1, се образува флуоросулфонова киселина HS03F:
Флуоросулфоновата киселина е безцветна течност с плътност при 18° от 1,740g/cm3,замръзва при -87,3°, кипи при 162,6°. Безводната флуоросулфонова киселина се разпада на йони H+ и S03F_ и само в малка степен на HSO3 и F-, както и на H2F+ и S206F.Разтваря добре повечето флуориди1-29.
Натриевият флуорид NaF има плътност от 2,79g/cm3и се топи при 995°C, над точката на топене има значителна летливост30. Наситен воден разтвор съдържа при 0° 3,95%, при 94° 4,73% NaF. Топлината на разтваряне на NaF във вода при 25° е 0,213kcal/mol.По време на съхранение натриевият флуорид се утаява (флуоридите на алкални метали, включително NaF, са хигроскопични).
Калиевият флуорид KF има плътност от 2,48g/cm3,се топи при 856°. За разлика от NaF, той е силно разтворим във вода: наситеният разтвор съдържа при 20° 47,75%, при 100° 59,83%, при 140° 60,5%, при 500° 71% KF. От водните разтвори се открояват кристални хидрати: KF • 4H20 (от -21,8 до 17,7 °), KF • 2H20 (17,7-45 °); над 45° безводен KF кристализира. На системите NaF-NaOH и KF-K. вижте 31 за системите NaF–KF и т.н.32 (в системата NaF–KF евтектиката е при 710°, 60% KF).
Амониевият флуорид NH4F има плътност от 1,315g/cm3,сублимира, без да се топи.Наситен воден разтвор съдържа 45% NH4F при 20°. Под -16,8° NH4F • H20 кристализира. Амониевият флуорид е единственото неорганично съединение, за което са открити смесени кристали с лед; съдържат до 10% NH4F 33-35.
Флуоридите на алкалоземните метали имат следната разтворимост във вода при 18° (вg/l)MgF2 - 0.0874, SrF2 - 0.1173, BaF2 - 1.605. Продукт на разтворимост на CaF2 при 18° 3,4-10
P; при 18° и pH = 7 разтворимостта на CaF2 е 0.000205g-mol/l36.Калциевият флуорид има плътност от 3.18g/cm3,се топи при 1418°31. Магнезиевият флуорид има плътност 3.0g/cm3,точка на топене 1396° (според други източници 38 1256°). Над 900° MgF2 се хидролизира интензивно от пара38.
В системата CaF2-SiO2 евтектиката е при 1240° (47% SiO2)39. За системата CaF2–CaO–P205 вижте справка 40.
Алуминиевият флуорид A1F3 има плътност от 3.07g/cm3.Налягането на парите на AIF3 при 1094° е 31mmHg. Art.,при 1251° 614mm Hg. Члени при 1294 ° 760mm Hg. st.При 800-1000 ° (във вакуум при 650-700 °) BF3 взаимодейства с алуминий, образувайки монофлуорид (AlF) ^ съществува само в газообразно състояние и се разлага при
Кондензации; - (A1F) * -> 2Al + A1F3. Безводният A1F3, получен по сух начин, е практически неразтворим във вода; кристалният хидрат, получен от разтвори, е слабо разтворим - наситен разтвор при 0 ° съдържа 0,127%, при 20 ° 0,498%, при 50 ° 0,805% и при 102 ° 2 42% A1F3. При 20°C 2,4–2,84% AIFs се разтварят в 10% разтвор на HF и 2,87–3,1% AIF341 в 15% разтвор на HF. В разтвори е силно хидролизиран; обикновено кристализира като AIF3 • 3H20. Известни са и други кристални хидрати: AIF3 • 9H20, AIF3 • 3.5H20, A1F3 • H20, A1F3 • 0.5H20 Колкото по-висока е степента на дехидратация A! F3, толкова по-малкохигроскопичност42.
Криолитът Na3AlF6 или 3NaF •AIF3е комплексна сол на хексафлуороалуминиева киселина H3[A1F6]. Името криолит (в превод от гръцки означава "леден камък") е дадено поради външната прилика с леда на естествения минерал, използван в технологията заедно с изкуствения. Криолитът се топи при 1011°. Предполага се, че в стопилката на криолита комплексният анион [A1F6]3
частично се дисоциира в [A1F4]
и F". Възможно е този процес да протича и под точката на топене, което обяснява високата електропроводимост на криолита при температури под точката на топене и малкия скок в електропроводимостта по време на топенето му.
Две твърди фази могат да съществуват в системата NaF–AIF3–H20 при 25°C: при концентрации на NaF под 1,4%, NanAl4F23 или 3Na3AlF6 · 2NaF · A1F3 се разтваря конгруентно, а криолитът Na3AlF6 се разтваря неконгруентно при концентрации на NaF над 1,4% и Na3A! F6 • 0,5H20 и хиолит Na5Al3Fi4 • H20. За да се дехидратират тези флуороалуминати, те трябва да се нагреят до 300°. Поради образуването на твърди разтвори в промишлената практика не е възможно да се получи криолит, съответстващ на формулата Na3AlF6 от водни разтвори - най-голямата стойност на модула на криолита (т.е. съотношението NaF: A1F3) в този случай е 2,75-2,8 47-49. Разтворимостта на криолита във вода при 25° е равна на 0,417g,, а при 16° е 0,35 g на 1000 g разтвор. За равновесието в системата NH4F-A1F3-H20 вижте справка 50.
Силициевият тетрафлуорид SiF4 е безцветен газ (критична температура -14,15 °, налягане 36,7at),когато се охлади, той преминава директно втвърда фаза. Твърдото вещество сублимира при -94,8° (при налягане 1318mm Hgсе топи при -90,2°, а при налягане 1520mm Hg- при -70°). Налягането на сублимация на твърд SiF4 (вmm Hg)се изчислява по формулата: logP= -6100/4.577'+ 10.382. Силициевият флуорид се редуцира от желязо, лесно реагира с метални оксиди; добре се абсорбира от вода (265 обема на 1 обем вода), докато се хидролизира и образува хидрофлуоросилициева и силициева киселина:
Този процес е толкова интензивен, че не се предотвратява от наличието на други киселини в разтвора (например до 50% H2SO4) 51.
Хидролизата на SiF4 с водна пара при температури до 600-800° протича в незначителна степен.
Комплексната флуоросилициева киселина H2SiFe също се образува чрез разтваряне на SiF4 във флуороводородна киселина:
В течния сух флуороводород SiF4 не се разтваря, но колкото повече влага има в течния флуороводород, толкова по-голяма е разтворимостта на SiF4 в него. При концентрация на HF повече от 96%, разтворимостта на SiF4 е по-малка от 0,05% (фиг. 321) 52. Високата концентрация на водородни йони в разтворите на H2SiFe се обяснява с изместване вдясно на равновесието на дисоциация на HF (2HF^2H + + 2F_) поради свързване -