Хидратационни числа - Наръчник на химика 21
Химия и химична технология
Числа за хидратация
За апатитовия концентрат гипсовото число е G = 1,6, полухидратното число G е 1,35–1,4.[c.257]
Като се има предвид взаимодействието на монозахаридите с водата, трябва да се има предвид, че тези многофункционални молекули могат да включват молекули на разтворителя в тяхната хидратационна обвивка не само чрез образуване на силни водородни връзки с еОН групи. При определяне на общото число на хидратация трябва да се има предвид възможността за образуване на слаби Н-връзки, например с несподелените електронни двойки на кислородния атом в пръстена, както и участието на молекулите на водната среда в хидрофобната хидратация на неполярните области на разтворените молекули [44]. Авторите на [44] подчертават, че броят на H2O молекулите, участващи в хидрофобната хидратация, зависи особено силно от стереохимичните характеристики на въглехидратните молекули. Вероятно поради тази причина числата на хидратация на монозахаридите, определени по различни методи, са доста различни и често значително надвишават броя на еОН групите.[c.79]
За да бъде числото на хидратация на разтвора равно на 8, е необходимо за всяка молекула H28 04 да има 8. молекули H2O, т.е. последната трябва да бъде 8 пъти повече[c.24]
Екстрахируемостта на аниони чрез механизма на образуване на йонни асоциати се увеличава в серията екстрагенти от етери до сулфоксиди (виж таблица 3.42). Тази серия може да се разглежда като серия от основности на кислородсъдържащи екстрагенти, разбирайки последното като способността за солватиране на протон. Екстракцията по подобен механизъм не е изключена за киселинните екстрагенти, но се проявява само като ефект, съпътстващ екстракцията чрез йонообменния механизъм. Като) оскъдни идеи за структурата на катионната част на йоннатасътрудници не са еднозначни. Хидратиращото число на протона във водните разтвори е четири, т.е. всеки хидрониев йон H3O се хидратира от три водни молекули. Когато хидратиран протон взаимодейства с кислородсъдържащи молекули на екстрагента, последните се координират около него с частично заместване на водните молекули с молекули на екстрагента или просто чрез солватиране на протона заедно с хидратната обвивка. Съответните катионни образувания се наричат хидратни солвати, а механизмът на извличане на анионни форми на елементи, дължащ се на образуването на йонни асоциати с хидратни солвати на протони, се нарича хидратен солват. Хидратиращото число 4 не винаги се поддържа в катионната част на хидратните солвати и може да варира от 1 до 12, т.е. числата на хидрат и солватация далеч не са постоянни и могат да варират в зависимост от състава на фазите. По този начин, от гледна точка на образуването на екстрахируемата катионна част на йонния асоциат, екстракционната способност на кислородсъдържащите екстрагенти се определя от конкуренцията между процесите на хидратация и солватация на хидрониеви йони, а селективността на екстракцията се определя от образуването на екстрахируеми анионни форми на елементи във водната фаза.[стр.158]
Солватацията (за водни разтвори - хидратация) е образуването на силна връзка на всеки йон с определен брой диполни молекули на разтворителя в резултат на електростатичното взаимодействие на йони с диполни молекули на разтворителя. Броят на молекулите на разтворителя, свързани с йон, се нарича солватно или хидратационно число на йона. Ако силата на полученото съединение е достатъчно висока, тогава йонът, заедно с молекулите, които са го разтворили, извършва топлинно движение в разтвора като цяло. В този случай се говори за първична солватация (хидратация) на йони.[c.161]
Коефициентът на хидратация на този разтвор съгласно формула (I 16) е[c.19]
Вторият ефект е по-сложен и е свързан с естеството на изсолителя. Хидратацията на изсолващите йони намалява концентрацията на свободна вода и следователно повишава ефективната концентрация (активност) на екстрахируемото вещество. Коефициентът на активност нараства толкова повече и толкова по-ефективно действа осоляващото средство, колкото повече се хидратира. Свързването на вода от изсолващия агент насърчава дехидратацията на катиона на екстрахираното съединение и неговата солватация от молекулите на екстрагента. Този ефект не зависи от това дали изсолващият агент има или не общ йон с екстрахируемото съединение. Критерият за способността за изсолване на електролита може да бъде хидратното число, но не е достатъчно строг, тъй като хидратното число, определено по различни методи, се различава значително едно от друго. Според способността на техните соли да изсоляват, катионите могат да бъдат поставени приблизително в следващия ред[c.335]
Следователно равновесната разтворимост на вода в екстрагента Od = 3,78 X X = 68 mg / l и числото на хидратация a = 0,952 1,[c.142]
По този начин, ако има надеждни референтни данни за разтворимостта на водата в екстрагента, които не излизат от диапазона, посочен за Oo, и критичната грешка при оценката на хидратното число е около 0,05, хипотезата за валидността на предложената схема за воден транспорт и наличието на монохидрат във фазата на екстрагента може да се счита за оправдана при ниво на значимост Р = 0,01. Изборът на големи стойности на p в подобна формулировка на проблема ще доведе до по-тесен диапазон от критични стойности на двата оптимизирани параметъра и хипотезата ще бъде отхвърлена (поне по отношение на образуването на стабилен монохидрат във фазата на екстрагента). Това от своя страна налага ревизия илидопълнения към предварително предложената схема.[c.144]
Тук, 5 μ и свиваемостта на хидратния комплекс и свиваемостта на разтвореното вещество, съответно. От своя страна, оценката на свиваемостта на хидратен комплекс винаги се основава на познаването на стойността на l. Ако приемем, че числото на хидратация не зависи от температурата, желаните стойности могат лесно да бъдат получени от уравнението [виж. 124] чрез обработка на приближените експериментални данни в тесен температурен диапазон (в диапазона от 278-308 K след 5K)[c.157]
Резултатите от оценката на p, K и параметрите на уравнение (3.31) са представени в таблица. 3.13. От данните в таблицата следва, че стойностите на u и свиваемостта на хидратираните сфери са по-високи в случая на OgO. С увеличаване на концентрацията на изотопомера на уреята, в резултат на нарастващото припокриване на ко-сферите на хидратация, хидратационните числа намаляват. В тежка вода този ефект е по-изразен, отколкото в H2O. Това е под-[c.157]
Направен е опит за определяне на броя на солватите на съединенията, които могат да се извлекат. Използвахме метода за разреждане на активния разтворител с инертен, въпреки недостатъците на този метод, които са свързани по-специално с факта, че числата на хидратация не остават постоянни с промяна в концентрацията на разтворителя, а числата на солватите очевидно са свързани с числата на хидратите. За разредени разтвори на активни разтворители числата на солватите, подобно на хидратните числа, нарастват с увеличаване на концентрацията на киселина във водната фаза, а за[c.241]
Сравнението на изчислените стойности на осмотичните коефициенти за разтвори на NaCl при 25 °C с експерименталните дава малко по-голямо несъответствие, отколкото в предишния пример, което може да се дължи на недостатъчно обоснован избор на хидратационно число (за Na+ и Cb, P1 = Pg = 4)[c.28]
Намаляване на солвата и увеличаване на хидратачисла, тъй като концентрацията на H2504 се увеличава, очевидно може да обясни увеличаването на разтворимостта на сулфоксидите с увеличаване на концентрацията на сярна киселина.[c.47]
Пример 28. Взети са 24,5 g H2304 - Колко вода трябва да се вземе, така че числото на хидратация на разтвора да е 8[c.24]
Ако стойността на oo за температурата, при която е извършена екстракцията, е известна от наръчниците, близкото съответствие между експерименталните и референтните стойности може да служи като добро потвърждение за правилността на възприетата схема за воден транспорт (4.20). По същия начин близостта на коефициента на наклона (хидрационното число) до единица дава основание да се твърди, че възприетата схема е много вероятна.[c.143]
Измерванията на времената на надлъжна и напречна релаксация на О ядрата, както и на протонната и дейтронната релаксация на водата в разтвори на редица прости въглехидрати [45, 46] показват, че кратките времена на релаксация на водните молекули, свързани с ОН групите на разтвореното вещество, са приблизително пет пъти по-дълги от времето за изотропна преориентация на свободните водни молекули. Това показва образуването на силни Н-връзки между разтвореното вещество и молекулите на разтворителя. Авторите на [46] смятат, че хидратационните числа на монозахаридите съответстват на броя на хидроксилните групи в техните молекули.[c.77]

В 1H NMR спектъра на разтвор на Al(C104)3 във воден [He]-ацетон, дори при стайна температура, бяха записани два сигнала, съответстващи на свободна вода и вода от вътрешната хидратна обвивка на AR [245]. Добавянето на ацетон забавя протонния обмен. По този начин беше установено, че първичното хидратационно число на AR е 6 [245].[c.62]
С увеличаване на степента на солватация на нуклеофила, придружена от диференцирана солватация на реагенти, асоциати и активиран комплекс,относителната стабилност на последния намалява, което води до постепенно повишаване на централната енталпийна бариера на реакцията. При ниски числа на хидратация височината на тази бариера може да не надвишава енталпията на реагентите, което обяснява относително високата скорост на реакцията, наблюдавана при такива числа на хидратация. По-нататъшното увеличаване на хидратационното число в крайна сметка води до факта, че височината на централната енталпийна бариера става по-голяма от енталпията на реагентите и по този начин скоростта на реакцията рязко намалява [485].[c.199]
Някои критики на тази теория биха били направени от Стоукс и Робинсън, които посочиха, че параметърът n трябва да се разглежда не като броя на водните молекули в слоя, заобикалящ йона, а като число, което трябва да вземе предвид средния ефект на всички онези взаимодействия между йони и разтворител, които са големи в сравнение с kTb. Съгласно по-ранните теории за хидратацията, числата на хидратация са толкова високи, че при високи концентрации (например 1 М за солна киселина) всички водни молекули са свързани с йони и изобщо няма вода като разтворител. Следователно, уравнение (37) трябва да се подобри, така че стойността на n да намалява с увеличаване на концентрацията на електролита и за да се обясни това явление, трябва да се приеме, че йоните проникват в хидратационните обвивки на други йони. При тези условия значението на концепцията за обема на свободния разтворител става много несигурно и следователно приложимостта на тази теория е ограничена до междинен диапазон на концентрация (до 1 - 2 DV), в който проникването има по-малък ефект върху стойността на m.[c.575]
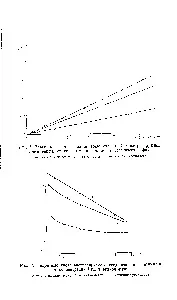
Интересно е, че при същите концентрации на хлоридни йони във водната фаза, числата на хидратация LiTl l4 за всички разтворители са по-малки отхидратационни числа HTI I4 (срв. [9]). Това може да се обясни с по-силната хидратация на хидрония, при която положителният заряд не се разпределя по повърхността, а се концентрира върху водородни атоми. Водните молекули в структурата на хидратиран хидроний, в резултат на миграция на положителен заряд, могат временно да се превърнат в хидроний и следователно да образуват силни водородни връзки с други водни молекули и с органичен разтворител. Хидратацията на литиевия йон се свежда най-общо до взаимодействието с най-близките водни молекули.[стр.115]
Голям интерес представляват данните за хидратационните числа на талиевите съединения, екстрахирани с разтвори на диетилов етер и други активни разтворители в инертни разредители - бензен, циклохексан и др. Оказа се, че за разлика от екстракцията с индивидуални разтворители, хидратационните числа за разредени разтвори, например 30% тегловни, не намаляват с увеличаване на киселинността във водната фаза, а напротив, нарастват или при по-високи концентрации преминават през максимум.[c.241]
Интересен въпрос е за хидратационните числа на водородните йони във водни разтвори. Установихме, че когато талият се екстрахира от разредени разтвори на солна киселина с диетилов етер, числата на хидратация на HT1C14 в органичната фаза достигат 9-10 и, както вече беше отбелязано, T1C14 не е хидратиран. Общите съображения показват, че числата на хидратация на протони в органичната фаза едва ли могат да бъдат по-високи от тези във водната фаза; по-скоро те дори намаляват. Ако това е така, тогава във водната фаза, поне при ниски концентрации, протонът се хидратира не от една (образува се H3O) и дори не от четири (HO или H3O -3H2O се образува) водни молекули, както често се смята, а от много по-голям брой от тях.[c.243]
В. С. Духанин и Н. Г. Ключников заЗа да се установи ефектът от магнитното третиране върху степента на хидратация на йони, беше използван ултразвуков метод за определяне на хидратационните числа на йони (вероятността да се намери средният брой водни молекули, които постоянно присъстват при дадени условия в близост до йона). Въпреки че такова определение е донякъде опростяване, но в първото приближение числата на хидратация могат да се използват, за да се прецени степента на йонна хидратация. Този метод се основава на определяне на степента на адиабатна свиваемост на разтворите от скоростта на ултразвука [19, p. 70-73] (метод на A. M. Pa-synsky). Степента на адиабатна свиваемост до голяма степен зависи от промяната (дори незначителна) в интензивността на йонните, молекулните и йономолекулните взаимодействия. Предполага се, че водата в хидратиращите черупки се компресира по-малко, отколкото в обем. Използване на ултразвуков скоростен анализатор тип[c.27]
Вижте страници, където се споменава терминътЧисла на хидратация :[c.428] [c.428] [c.163] [c.141] [c.116] [c.98] [c.100] [c.153] [c.158] [c.11] [c.11] [c.61] [c.113] [c.113] [c.1 16] [c.241] [c.242] [c.7] [c.7] Химически енциклопедичен речник (1983) -- [c.495]
Big Encyclopedic Dictionary Chemistry ed.2 (1998) -- [ c.493 ]