Химични методи за изследване на водата
Подспособност за окисляванеразбирайте способността на органичните вещества във водата да се окисляват от атомарен кислород. Стойността на окисляемостта се изразява с количеството кислород (mg), необходимо за окисляването на органични вещества, съдържащи се в 1 литър вода. Източникът на атомен кислород в тези реакции е калиев перманганат или бихромат, а окисляемостта съответно се нарича перманганат или бихромат. Обикновено окисляемостта се определя в кисела вода, но когато съдържанието на хлорид във водата е над 300 mg/l и е силно замърсена, изследването се провежда в алкална среда.
Перманганатен метод (по Кубел).Основава се на способността на калиевия перманганат да отделя кислород в кисела среда. По количеството консумиран кислород се съди за окисляемостта на водата.
Уреди и прибори: бюрети, пипети 5 ml, колби 250-300 ml, мерителни цилиндри 100 ml, епруветки, стъклени перли, фунии с диаметър 5-7 cm.
разтвор на калиев перманганат (0,01 N) - за това 0,316 g от лекарството се разтварят в 1 литър дестилирана вода; 1 ml от този разтвор съответства на 0,08 mg кислород. Разтворът се съхранява в тъмна бутилка със смляна капачка и се проверява при всяка серия от изследвания;
разтвор на оксалова киселина (0,01 N) - за приготвянето му се претеглят 0,63 g киселина и се разтварят в 1 литър дестилирана вода; 1 ml разтвор изисква 0,08 mg кислород за неговото окисление;
разтвор на сярна киселина (25%) с плътност 1,84 g / cm3 кубичен обем (1: 3) в дестилирана вода.
1) Няколко стъклени перли се поставят в конична колба от 250 ml и се наливат 100 ml вода, добавят се 5 ml сярна киселина (1: 3) и 10 ml разтвор на калиев перманганат (0,01 N). Сместа се загрява бързо до кипене (за 5 минути) и се държи на слаб огън около 10 минути. След това колбатаотстранете (разтворът трябва да е розов) и добавете 10 ml разтвор на оксалова киселина (0,01 N) към горещия разтвор. Обезцветеният горещ разтвор (при температура 80 0 С) се титрува с разтвор на калиев перманганат (0,01 N) до получаване на стабилен бледорозов цвят. Ако изследваната течност стане безцветна или стане светлокафява по време на кипене, тогава по-нататъшното изследване се спира и разтворът се излива. Взема се нова порция вода, която първо се разрежда с дестилирана вода 2 или 5 пъти и анализите се повтарят, както е посочено по-горе.
2) Нормалността на разтвора на калиев перманганат (стойност К) се определя, както следва. В колба с вместимост 250 ml се наливат 100 ml дестилирана вода, добавят се 5 ml сярна киселина (25%) и 10 ml разтвор на калиев перманганат (0,01 N). Течността се загрява и се вари 10 минути на слаб огън. След това към горещата течност се добавят 10 ml разтвор на оксалова киселина (0,01 N), което води до обезцветяване. След това, докато е горещ, се титрува с разтвор на калиев перманганат (0,01 N) до получаване на бледорозов цвят.
Коригиращият фактор (K) за титъра на 0,01 N разтвор на калиев перманганат се изчислява по формулата:
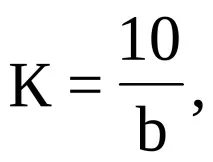
където 10 е количеството на 0,01 N разтвор на оксалова киселина, ml; b е количеството 0,01 N разтвор на калиев перманганат, добавено преди кипене и след това използвано за титруване, ml.
3) Окисляемостта на водата се изчислява по формулата:
където X е окисляемостта на кислорода в mg на 1 литър вода; a е количеството KMnO4 в ml, добавено преди кипене; b е количеството KMnO4, изразходвано за титруване, ml; K е корекционният коефициент за нормалността на KMnO4; 10 е количеството KMnO4, изразходвано за окисляването на оксаловата киселина; 0,08 е количеството кислород, съответстващо на 1 ml 0,01 N разтвор KMnO4; 1000 -прехвърлете в 1 литър вода; C е обемът на водата, взета за анализ, ml.
Поради факта, че някои минерални (оксидни) съединения - желязо, манган, нитрити, сероводород - също могат да бъдат окислени във вода, със значително съдържание на тях, е необходимо да се вземе предвид ефектът върху стойността на окисляемост (опитът се провежда без нагряване).
Определяне на окисляемостта в алкална среда (по Шулц).Този метод е приложим за определяне на окисляемостта на вода, замърсена с хлориди и др.
разтвор на калиев перманганат (0,01 N) - за това 0,316 g от лекарството се разтварят в 1 литър дестилирана вода;
50% разтвор на натриев хидроксид;
разтвор на оксалова киселина (0,01 N) - за приготвянето му се претеглят 0,63 g киселина и се разтварят в 1 литър дестилирана вода;
4) 20% разтвор на сярна киселина.
В конична колба се наливат 100 ml вода, добавят се 0,5 ml 50% разтвор на натриев хидроксид и 10 ml разтвор на калиев перманганат (0,01 N). Течността се нагрява и се вари в продължение на 10 минути от началото на появата на първите мехурчета, охлажда се до 50-60 ° C, добавят се 5 ml сярна киселина, 10 ml 0,01 N разтвор на оксалова киселина (течността трябва да се обезцвети; ако не, добавете още няколко ml оксалова киселина). След това се титрува с 0,01 N разтвор на калиев перманганат, докато се появи слабо розово оцветяване, което не изчезва в рамките на 3-5 минути. Изчислението се извършва по същата формула, както по метода на Kubel, резултатът се изразява в mg кислород на литър.
Експресен метод за определяне на окисляемостта. В епруветка се наливат 10 ml вода и се добавят 0,5 ml разтвор на сярна киселина, разреден в съотношение 1:3, и 1 ml 0,01 N разтвор на калиев перманганат. Сместа се разбърква старателно и се оставя да престои 20 минути при температура 20 0 С и 40 минути при температура 10-20 0 С. След това разтворът се изследва отстрани иотгоре и по цвят определят окисляемостта, която зависи от цвета. И така, ярък медено-розов цвят съответства на 1, лилаво-розов - 2, слаб лилаво-розов - 4, бледо лилаво-розов - 6, бледо розов - 8, розово-жълт - 12, жълт - 16 mg O2 / l и повече.
Азот от амоняк и амониеви соли. Количеството на амоняка и амониевия азот във водата се определя чрез колориметричен метод, чиято същност е, че при добавяне на реактив на Неслер към тестваната вода се образува меркурамониев йодид, който оцветява водата в жълто с различна интензивност в зависимост от съдържанието на амоняк. След добавяне на реактива на Неслер водната проба се сравнява със стандартен разтвор на амониев хлорид, съдържащ известно количество амониев азот. За колориметрия е подходяща вода с концентрация на амоняк в диапазона 0,1-10 mg/l.
Уреди и прибори: фотоелектричен колориметър - FEC, пипети 1 и 5 ml, колби 100 ml, градуиран цилиндър 100 ml и епруветки.
50% воден разтвор на рошелска сол;
алкална смес, състояща се от 50 g натриев хидроксид и 100 g натриев карбонат, разтворени в 300 ml дестилирана вода (приготвеният разтвор се вари 15 минути и се филтрира през азбестова вата);
Подготовка на водата за анализ: точността на определяне на съдържанието на амонячен азот и амониеви соли във водата се влияе от нейния цвят и твърдост, съдържанието на желязо, сулфити и свободен въглероден диоксид. За да обезцветите 500 ml вода, добавете 0,5 g алуминиев хидроксид и утайката се утаява за 2 часа,
Сулфидите се определят, както следва: 1 ml реактив на Неслер и след това 2 ml разтвор на сярна киселина (1: 3) се добавят към 10 ml вода. Ако мътността не изчезне след подкисляването на водата, значи тя съдържа сулфиди, които трябва да се отстранят чрез добавяне на 10 ml вода на 100 ml вода.капки от 30% разтвор на цинков ацетат. След това водата се утаява за 2 часа, прозрачната част се отцежда и от нея се вземат проби за изследване.
Когато твърдостта на водата е повече от 3,5 mg / екв. l го омекотява, за това 2 ml сода каустик се добавят към 100 ml вода и разтворът се утаява за 2 часа.
Метод на изследване. В едната колба се наливат 100 ml от стандартния разтвор на амониев хлорид, а в другата - 100 ml от изпитваната вода. След това в двете колби се добавят 3 ml 50% разтвор на сол на Rochelle и 2 ml реактив на Nessler. Съдържанието на колбите се разклаща и се оставя за около 10 минути, докато се появи цветът.
Колориметрията се извършва на FEC с филтър за синя светлина (№ 4) в кювети с дебелина 1-5 см. Оптичната плътност на стандартния разтвор на тестваната вода се определя на FEC точно 10 минути след добавянето на реактива на Nessler (взема се предвид редът на добавяне на реагентите и тяхната колориметрия). Изчислението се извършва по формулата:
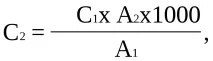
където C2 е концентрацията на амоняк и амониев азот в изпитваната вода, mg/l; C1 - същото в стандартен разтвор на амониев хлорид, mg/l; A1 е оптичната плътност на стандартния разтвор на амониев хлорид (по червената скала); A2 - оптична плътност на изследваната вода (червена скала); 1000 - прехвърляне на 1 литър.
Определяне на амоняк чрез приблизителен метод. Изсипете 10 ml тестова вода в епруветка, добавете 0,2-0,3 ml 50% разтвор на сол на Rochelle, разбъркайте добре и добавете реактив на Nessler. Определянето на амоняка се извършва съгласно таблица 38.
Нитритен азот. Принципът на изследването е, че водата, съдържаща нитрити, когато се добави реактивът на Griess, става розова. За откриване на нитрити се използва реактив на Griess - разтвор на алфа-нафталамин и сулфанилова киселина в оцетна киселина. Със съдържанието на нитрити във водатанад 0,3 mg/l, водата се оцветява в жълто. Границата на чувствителност на реактива е 0,01 mg/l нитрит.