ХИМИЯ 10 - Страница 21
В химичните съединения азотните и фосфорните атоми могат да проявяват степени на окисление от до +5. Фосфорните атоми, в сравнение с азотните атоми, имат по-голям радиус и по-ниска стойност на електроотрицателност. Фосфорът често проявява степен на окисление +5 в съединенията.
Разпространение в природата
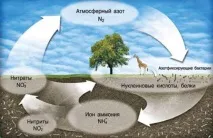
Азот. Земната атмосфера служи като основен източник на този най-важен елемент, тъй като обемната част на простото вещество азот във въздуха е 78%. В природата азотът се среща и в отлагания на селитра - соли на азотната киселина (NaNO 3 - чилийски или натриев нитрат; KNO 3 - калиев нитрат). Азотът е компонент на протеините и е от съществено значение за растежа на растенията и развитието на животните. Цикълът на азота в природата (фиг. 64) е най-важната връзка в живота на нашата планета.
Фосфорът се среща в природата само под формата на съединения. Най-важните естествени фосфорни съединения са минералите фосфорити и апатити, съдържащи калциев фосфат Ca 3 (PO 4 ) 2 .
Ориз. 64. Кръговрат на азота в природата
Съединенията, съдържащи фосфор, са постоянен компонент на тъканите на човешки, животински и растителни организми. Костите и зъбите съдържат особено много фосфор. След смъртта на растителни и животински организми съдържащият се в тях фосфор отново преминава в почвата. Ето как работи
кръговрат на фосфора в природата.
Част от фосфора в човешкото тяло се разпределя в мускулната, нервната и мозъчната тъкан. Производните на фосфорната киселина са част от нуклеиновите киселини – ДНК
и РНК, осъществяващи преноса на наследствените свойства на организма. От фосфор, който влиза в човешкото тяло с храна, главно с яйца, месо, мляко
и хляб се образува АТФ – аденозинтрифосфорна киселина.
Простото вещество азот еот двуатомни молекули N 2 . В молекулата на N 2 азотните атоми са свързани помежду си чрез тройна ковалентна неполярна връзка (една и две. Енергията на тройната връзка е голяма и възлиза на 946 kJ / mol. Такава голяма стойност показва високата якост на молекулата. Следователно разкъсването на връзките и образуването на атоми от азотни молекули се случва само при температури над 3000 C. Високата якост на връзката в нитро gen молекули определя неговата химическа инертност.
Химичният елемент фосфор образува няколко алотропни модификации, които се различават по структура, физични свойства и химична активност. Белият фосфор се състои от молекули P 4, които имат формата на пирамида (фиг. 65, а). Молекулярната структура на това вещество определя неговата плавимост и летливост. При нагряване под налягане белият фосфор се превръща в черен, който по своите физически свойства е подобен на метала: провежда електричество и свети.
Ориз. 65. Структурата на белия (а) и червения (б) фосфор
Простото вещество червен фосфор има полимерна структура, в която всеки атом е свързан с три други атома чрез ковалентни връзки.
Алотропните модификации на фосфора в уравненията на химичните реакции се означават със символа R.
Физичните свойства на азота и фосфора са показани в таблица 17. Азотът е слабо разтворим във вода.
Таблица 17. Физични свойства на азота и фосфора