Химия и производство
Сред химическите реакции, извършвани в лабораторията, има подобни, които се извършват в индустриални условия за производство на различни химически продукти (пластмаси, фармацевтични продукти, багрила, торове, пестициди и различни химикали - сярна, солна и азотна киселина, амоняк, етилен и др.).
Клонове на химическата промишленост
Клонът на националната икономика, отговорен за производството на продукти, базирани на химическата обработка на суровините, се нарича химическа промишленост. Най-важните отрасли на химическата промишленост:
- неорганична химия (производство на амоняк, сярна киселина, сода)
- органична химия (производство на фенол, етилен, карбамид и др.)
- силикатна промишленост (производство на керамика)
- нефтохимия (производство на бензен, стирен)
- агрохимия (производство на торове, пестициди)
- производство на полимери (полиетилен, полиестер и др.) и еластомери (каучук, неопрен, полиуретани)
- производство на експлозиви (нитроглицерин, амониев нитрат)
- фармацевтика (производство на лекарства), производство на парфюмерия и козметика (кумарин, ванилин, камфор)
Основата на химическата промишленост е химическата технология - науката за най-икономичните методи и средства за масова химическа обработка на природни материали (суровини) в потребителски продукти и междинни продукти, използвани в различни сектори на националната икономика.
Най-важното от гледна точка на химичната технология е производството на амоняк и метанол. Тези вещества са основните връзки, които пораждат цяла поредица от нови индустрии. И така, азотната киселина се получава от амоняк (използва се за производството на торове, лекарства, багрила, пластмаси,изкуствени влакна, експлозиви) или урея. След получаване на метанол, той може да се използва в производството на формалдехид, който от своя страна отива за производството на фенол-формалдехидни смоли и полиметилметакрилат.
Производство на амоняк
Помислете за процеса на производство на амоняк (фиг. 1), който се основава на реакцията:
N2 +3H2 2NH3 + 92 kJ.
Тъй като реакцията е обратима и производството е насочено към получаване на целевия продукт - амоняк, е необходимо да се изберат оптималните условия за синтез въз основа на характеристиките на химичната реакция. По този начин повишаването на налягането ще допринесе за изместване на равновесието към образуването на амоняк.
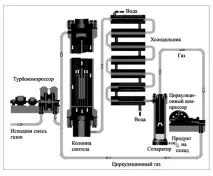
Ориз. 1 Инсталация за производство на амоняк в индустриален мащаб
Въпреки факта, че според принципа на Le Chatelier, за да се измести равновесието към продуктите по време на екзотермична реакция, е необходимо да се понижи температурата, реакцията се провежда при оптималната температура за този процес: 450–500 ° C, тъй като когато температурата се понижи, скоростта на синтез на амоняк ще бъде много ниска.
За ускоряване на синтеза се използва катализатор, който е редуцирано желязо, активирано с калиев или алуминиев оксид. Въпреки това, при горните условия, равновесният добив на амоняк е не повече от 20%. Следователно, синтезът се извършва по метода на многократна циркулация, т.е. нереагиралата смес от газове се връща многократно в производството след отделяне на получения продукт от него.
Производство на анилин
Нека разгледаме производството на анилин като мащабно производство на органични вещества (фиг. 2). Анилинът (C6H5NH2) е най-простият ароматен амин. Анилинът се използва за производство на полиуретани (първоначално от анилинсе получават метилдиизоцианати, а след това и самите полиуретани), изкуствени каучуци, багрилни хербициди, експлозиви и лекарства (сулфаниламидни препарати).
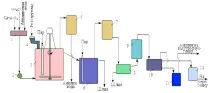
Ориз. Фиг. 2. Схема за получаване на анилин чрез непрекъснато редуциране на нитробензен с чугунени стружки: 1 - смесител; 2— помпа; 3—редуктор; 4 - шнеково захранващо устройство; 5, 7 - кондензатори; 6 - апарат за дестилация на анилин; 8 - утайник; 9 - хладилник; 10 - сепаратор; 11 - събиране на суров анилин; 12 - събиране на анилинова вода
Получаването на анилин се извършва на два етапа. Първо, нитробензенът се получава чрез реакция на нитриране на бензен със смес от концентрирана азотна и сярна киселини при температура 50-60 ° C, а след това нитробензенът се хидрогенира при температура 200-300 ° C в присъствието на катализатори, като желязо: