Как киселинността зависи от природата на разтворителя
Разтворителите имат силно влияние върху стабилизирането на получения анион (солватационен ефект). По-малките йони с ниска степен на делокализация на заряда са по-добре хидратирани. Например, в серията от карбоксилни киселини, тъй като дължината на алифатния (хидрофобния) радикал се увеличава, киселинността намалява.
33. Защо реакцията на натрий с алкохол е по-бавна, отколкото с вода?
Трябва да се отбележи, че реакцията между алкохол и натрий не протича толкова енергично, колкото реакцията на натрий с вода. Други метали, които изместват водорода от водата относително лесно, като калций, действат още по-бавно върху алкохола. По този начин киселинните свойства на алкохола са по-слабо изразени от тези на водата.
34. Защо водата разлага натриевия етоксид?
CH3-CH2-O(-) + H-O-H -----> CH3-CH2-O-H + H-O (-).
Реакцията се свежда до факта, че етилният анион "откъсва" протон от водна молекула.
Може да се тълкува и по друг начин: тъй като е по-силна киселина от етанола, водата прехвърля своя протон към етилния анион, докато самата тя се превръща в хидроксиден анион.
По този начин това е най-честата киселинно-алкална реакция: по-силна киселина (вода) измества по-слаба киселина (етанол) от нейната сол (натриевият етоксид може и трябва да се счита за сол).
35. Основност на диетиламин и анилин
(C2H5)2NH.
Поради наличието на несподелена електронна двойка в молекулите, амините, подобно на амоняка, проявяват основни свойства. В ред
анилин амоняк първичен амин вторичен амин
основните свойства се подобряват, поради влиянието на вида и броя на радикалите.
Следователно диетиламинът е по-силна основа от анилина.
36 обща характеристика на реактивността на хетерофунови съединения.Киселинно-алкални свойства.
Веществата от естествен произход често са представени от хетерофункционални съединения, тъй като те включват комбинация от различни функционални групи - карбоксилни, хидроксилни, карбонилни, амино групи и др. Възможно е в този случай да има няколко идентични функционални групи в молекулата.
В първото приближение химичните свойства на хетерофункционалните съединения са сумата от свойствата, дължащи се на всяка група поотделно. Въпреки това, в много случаи присъствието на две (или повече) различни функционални групи води до увеличаване или намаляване на свойствата, присъщи на монофункционалните съединения, и, което е по-важно, поражда специфични химични свойства, присъщи само на хетерофункционалните съединения. Киселинността на хидрокси киселините е по-висока от тази на незаместените карбоксилни киселини. Това се дължи на електрон-оттеглящия ефект на хидроксилната група (-I-ефект) и колкото по-близо е до киселинния център, толкова по-силен е този ефект. По този начин pKa на млечната киселина е с порядък по-висок от този на пропановата киселина (3,9 и 4,9, съответно).
Аминокиселините съдържат както киселинни (COOH), така и основни (NH2) групи. Обичайно писане на формули на аминокиселини като съединения,
, съдържащ амино и карбоксилна група, например RCH(NH2)COOH, е условен и не отразява истинската им структура. Както в кристално състояние, така и в среда, близка до неутралната, аминокиселините съществуват под формата на вътрешна сол - диполярен йон, наричан още цвитер йон (от немски Zwitter - смесен тип).
В силно кисела среда в аминокиселините, аминогрупата (катионна форма) е напълно протонирана и карбоксилната група не е дисоциирана. В силно алкална среда, напротив, аминогрупата не е протонирана, акарбоксилната група е напълно йонизирана (анионна форма)
37. Хетерофункционален заместител като фактор, влияещ върху химичните свойства на реакционния център. Специфични реакции на хетерофункционални съединения.



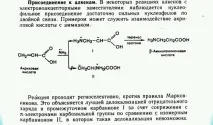



38.биологично важни класове хетерофункционални съединения и техните свойства. ненаситени карбоксилни киселини. Хидрокси киселини, аминокиселини, оксо киселини. Напишете реакцията на взаимодействието на ацетооцетния естер и сярната киселина.
Сред хетерофункционалните съединения в природни обекти най-често срещаните са аминоалкохолите, аминокиселините, хидроксикарбонилните съединения, както и хидрокси и оксо киселините. Едноосновните ненаситени киселини съдържат ненаситен въглеводороден радикал, свързан с карбоксилна група. Общата формула на такива киселини (с една двойна връзка) е C H2p-COOH. Молекулата на ненаситена карбоксилна киселина може да съдържа две или повече етиленови връзки, както и тройна връзка. Акрилова киселина CH2=CH-COOH, метакрилова киселина CH2=C(CH3)-COOH, кротонова киселина CH3-CH=CH-COOH, пропинова киселина CH=C-COOH и висши ненаситени киселини (олеинова, линолова и линоленова) могат да бъдат примери за такива киселини. Оксокиселините са съединения, които съдържат както карбоксилни, така и алдехидни (или кетонни) групи в молекулата.
В съответствие с това се разграничават алдехидните киселини и кетоновите киселини.
Най-простата алдехидна киселина е глиоксаловата (глиоксилова) киселина, която обикновено съществува като хидрат (HO)2CHCOOH. Намира се в неузрелите плодове, но с узряването количеството му намалява Хидрокси киселините са съединения, съдържащи се в молекулатаедновременно хидроксилни и карбоксилни групи. Аминокиселините съдържат аминогрупа и карбоксилна група в молекулата.
В алифатната серия, според взаимното разположение на функционалните групи, α-, β-, γ- и т.н., се разграничават хидрокси- и аминокиселини. Буквата от гръцката азбука показва позицията на друга функционална група спрямо карбоксилната група, докато броенето е от въглеродния атом, който е най-близо до карбоксилната група, т.е. от атома С-2. Имайте предвид, че в заместващата номенклатура за заместени карбоксилни киселини не се използват локанти α-, β-, γ- и т.н.
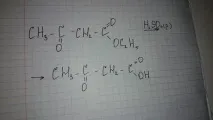
39. Биологично важни хетероциклични системи. Петчленни хетероцикли с един хетероатом. Пирол, фуран, тиофен. Концепцията за структурата на тетрапиролните съединения. Линейни тетрапиролни съединения.
Най-важните хетероцикли, които формират основата на много естествени биологично активни вещества и лекарства, са показани на диаграмата
70. Правилото на Duclos-Traube е връзка, която свързва повърхностната активност на воден разтвор на органично вещество с дължината на въглеводороден радикал в неговата молекула. Съгласно това правило, с увеличаване на дължината на въглеводородния радикал с една CH2 група, повърхностната активност на веществото се увеличава средно с коефициент 3,2.
71. Теорията на Langmuir се основава на следните положения:
1). Основната позиция на теорията на Langmuir: повърхността на адсорбента е ограничена. Адсорбцията на веществото не се извършва на цялата повърхност, а само на активните центрове. Такива центрове могат да бъдат отделни атоми или групи от атоми, изпъкнали над повърхността на адсорбента.
2). Всяко активно място съдържа само една молекула.
3). Когато всички активни места са заети и повърхността на адсорбента е покритаслой с дебелина една молекула (мономолекулен слой), установява се адсорбционно равновесие и по-нататъшното увеличаване на адсорбцията е невъзможно.
4). Процесът на адсорбция има динамичен характер. При равновесие скоростта на адсорбция и десорбция е една и съща. Адсорбираните молекули остават свързани с активните центрове известно време, след което напускат повърхността (десорбират) и други молекули заемат тяхното място.Времето на престой на молекулата върху активния център зависи от температурата.
5). Молекулите, адсорбирани върху активни центрове, не взаимодействат помежду си.
Уравнението на изотермата на мономолекулярната адсорбция на Langmuir има формата:
, (1)
където A и A¥, съответно, са стойностите на адсорбция на газ или пара за дадено и ограничаващо запълване на монослоя; K е адсорбционната равновесна константа, p е равновесното налягане на газ или пара.
Това уравнение характеризира интензивността на взаимодействието между адсорбента и адсорбата.
За адсорбцията на вещества от разтвори, уравнението
, (2)
където G е адсорбцията на Гибс при концентрация С; G¥ е максималната или ограничаваща адсорбция, съответстваща на образуването на монослой, С е равновесната концентрация на вещество в разтвор.
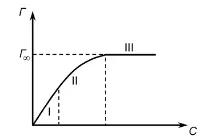
Зависимостта на стойността на адсорбция от концентрацията е показана на следващата фигура
, (3)
В координатитеС/Г—Сполучаваме права линия, а от графиката намираме стойноститеГ¥ иК(фиг. 1). Познавайки експерименталната стойностГ¥, е възможно да се изчисли площта на напречното сечение на молекулата и нейната дължина.
74.КОЛОИДЕНХИМИЯ, областхимия,изучаванена дисперсни системи и повърхностни явления, които възникват на границата.
Дисперсната системае образувание от две или повече фази (тела), които практически не се смесват и не реагират химически една с друга.
Дисперсносттае физическа величина, която характеризира размера на суспендираните частици в дисперсни системи. Това е стойност, показваща колко частици могат да бъдат плътно опаковани в един кубичен метър.