Кинетична класификация на химичните реакции
В основното кинетично уравнение на химичната реакция aA + bB + ... →
= k·

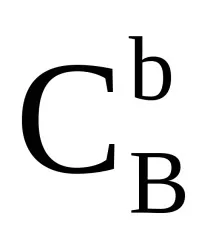
a,b, …–това са постоянни числа, които не зависят от концентрацията на дадено вещество, наречени съответно индикатори за реда на реакция за реактиви A, B, …. Тяхната сума (a+b+…=n) се нарича общ или общ ред на реакцията.
Реакционният ред за всеки от реагентите (или конкретен реакционен ред)съвпада с неговия стехиометричен коефициент в химическото уравнение само за прости реакции, протичащи в един етап. В същото време в елементарния акт на такава реакция (сблъсък) участват и претърпяват промени не повече от три частици: молекули, йони или радикали. В съответствие с това се разграничаватмономолекулни,бимолекулярниитримолекулниреакции (последните са изключително редки). Тетра- и по-молекулните прости реакции са неизвестни, тъй като вероятността за едновременен сблъсък на 4 или повече частици е изключително малка. По този начин молекулярността на реакцията може да бъде изразена само като цяло число.
В елементарния акт на мономолекулна реакция една частица претърпява трансформацияи не само една, но и две други частици (в някои случаи три или повече) могат да се образуват като продукт. Схематично това може да се представи по следния начин:
A → B; A → 2B; A → B + C; A → B + C + D.
Кинетичното уравнение за такива реакции изглежда така:
Това е уравнение на реакция от първи ред (нещо повече, частичният и общият ред в него са еднакви и равни на 1).
Мономолекулните реакции обикновено саса ендотермични и за възникването им е необходима активация, т.е. преходът на частицата А във възбудено състояние А *, чиято енергия е достатъчна за преодоляване на потенциалната бариера по пътя на реакцията.
Мономолекулните реакции най-често са разлагане или изомеризация на определени вещества, например:
1) дисоциация на бромни молекули на 2 радикала
Br2102Br;
2) термично разлагане на диметилов етер
CH3 - O - CH3
3) изомеризация на амониев тиоцианат до тиокарбамид
В елементарния акт на бимолекулна реакция две (еднакви или различни) частици претърпяват трансформация с образуването на една или повече частици продукт:
2A → C; 2A → C + B; A + B → C + D;
A + B → C; A + B → C + D + F
Кинетичното уравнение на такива реакции, в зависимост от вида на първоначалните частици, е както следва:
1) =k·

2) =k CA CB (ако частиците на реагента са различни по природа).
И в двата случая общият ред на реакцията е 2. Освен това, за реакциите от първия тип, той съвпада с конкретния ред на реакцията по отношение на реагент А. За реакциите от втория тип, конкретният ред на реакцията по отношение на всеки от реагентите е 1.
Бимолекулярните реакции са най-често срещаните, обикновено протичат в газова или течна фаза и могат да бъдат от много различни видове, например:
Тримолекулните реакции са прости реакции, в елементарния акт на които три частици се сблъскват и претърпяват промени.
В зависимост от природата на тези частици (т.е. дали са еднакви или различни), кинетичното уравнение за такава реакция може да има три различни форми:
= k

=k

Общият ред на реакцията във всеки от трите случая е 3 и е сумата от частичните редове за всеки от реагентите. Тримолекулните реакции са много редки и следователно нямат практическо значение. Примери за такива реакции са следните: