Класификация на органичните реакции и реагенти
В процеса на химичните реакции някои химични връзки се разрушават и се образуват нови химични връзки с преразпределение на електронната плътност на атомите на реагиращите вещества. Атом или група от атоми, участващи в разкъсването или образуването на връзки, се нарича реакционен център. Способността на съединението да влиза в определена химична реакция и да реагира с определена скорост е характеристика на неговата реактивност.
Реактивността на дадено съединение винаги трябва да се разглежда само по отношение на партньора. За удобство едно от реагиращите съединения е обозначено като субстрат, а съединението, действащо върху него, като атакуващ реагент. В органичната химия съединение се нарича субстрат, чиято молекула доставя въглероден атом за образуване на нова връзка. За класифициране на органичните реакции се използват следните знаци:
• естеството на промяната на връзките в реагентите;
• броя на молекулите, участващи в етапа, който определя скоростта на реакцията.
Естеството на промяната на връзките в субстрата и реагента. На тази основа реакциите се делят на радикални, йонни и съгласувани.
радикални реакции. С хемолитичното разкъсване на ковалентна връзка се образуват радикални реагенти, които имат по един несдвоен електрон:
Свободният радикал е атом или група от атоми с несдвоен валентен електрон. Примери за радикални реагенти са халогените Br•, Cl•, хидроксил HO•, хидропероксил HOO•, алкилперокси ROO• и алкил R•. Наличието на несдвоен електрон причинява ниска стабилност и висока реактивност. Високата реактивност се обяснява с желанието да се завърши външното електронно ниво до стабилно ниво.октет. Съществуват обаче и относително стабилни свободни радикали, които могат да делокализират несдвоен електрон по протежение на система от спрегнати множествени връзки, например трифенилметил (C6H5)3C• бензил C6H5CH2• и алил CH2=CH—CH2•.
Йонни реакции. При хетеролитично прекъсване на ковалентна връзка, двойка електрони отива към един от партньорите на връзката. В този случай се образуват електрофилни и нуклеофилни частици:
Електрофилните реагентиса частици, които образуват нови ковалентни връзки благодарение на двойка партньорски електрони (означени със символите E или E +).Нуклеофилните реагентиса частици, които образуват нови ковалентни връзки със своя партньор, осигурявайки двойка електрони за това (обозначени със символите Nu или Nu - ).
Електрофилните и нуклеофилните частици също могат да участват в реакциите като междинни частици - йонни междинни съединения.


Координирани (синхронни) реакции. При тези реакции разкъсването на стари връзки и образуването на нови връзки се извършват едновременно без участието на радикални или йонни видове. Тези реакции протичат през циклично преходно състояние. Реакции от този тип се наричат перициклични.
Посоката на реакцията. Според насочеността на процеса органичните реакции се разделят на няколко основни вида.
реакции на заместване. Те се обозначават със символа S (от англ. substitution). Заместването, в зависимост от естеството на атакуващия реагент, може да бъде радикално, електрофилно или нуклеофилно:
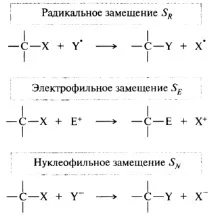
Заместимата част на субстрата X се нарича напускаща група. Група, която остава без двойка електрони, се нарича електрофузия; напускане с двойка електрони - нуклеофуга. При радикално заместване изходящият свободен радикал незабавно влизапо-нататъшна реакция.
Реакции на присъединяване. Тези реакции се означават със символа А (от английското допълнение). Прикрепването към множество връзки може да се осъществи чрез три възможни механизма (например C=C връзката):
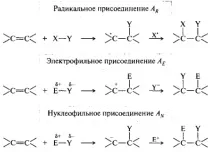
Реакции на разцепване (елиминиране). Означават се със символа Е (от англ. елиминация). По правило тези реакции се извършват като β-елиминиране, когато напускащите групи напускат съседните въглеродни атоми. Групите X и Y могат да напуснат последователно или едновременно, те могат или не могат да се слеят.
Пренареждания. В процеса на пренареждане има преход (миграция) на атоми или групи от един атом към друг. Най-често срещаният тип пренареждания е 1,2-пренареждания (1,2-смени). В този случай мигриращата група преминава към съседния атом. Мигриращата група може да прехвърля с един или двойка електрони:
перициклични реакции. Образуването на връзки в краищата на реагиращите молекули се случва съвместно с едновременното преразпределение на π-връзките в рамките на цикличното преходно състояние. Перицикличните реакции включват циклоприсъединяване, електроциклични реакции, сигматропни пренареждания и реакции на трансфер на групи.
В процеса на циклодобавяне две ненаситени молекули се комбинират, за да образуват цикличен адукт с преразпределение и общо намаляване на броя на връзките:
Обратната реакция на циклоприсъединяване се наричациклоразпад.
При електроцикличните реакции циклизацията включва образуването на σ връзка между краищата на конюгирана линейна π електронна система:
Сигматропните пренареждания включват разкъсването на σ-връзка в оригиналната молекула и образуването на нова σ-връзка между преди това несвързани атоми:
В реакциите на групов трансфер,синхронен обмен на връзки около пръстена. Напускащите групи образуват нова молекула с връзка въглерод-въглерод, а в оригиналния субстрат множествеността на връзката се увеличава:
Редокс реакции. По време на тези реакции степента на окисление на въглеродния атом, който действа като реакционен център, се променя. Процесът на окисляване включва прехвърляне на електрони от органичния субстрат към окислителния реагент, докато процесът на редукция включва прехвърляне на електрони от реагента към органичния субстрат. Редокс природата на органичните реакции не е толкова ясна, колкото при неорганичните. Някои реакции включват директен пренос на електрон, докато други не включват директни стъпки на пренос на електрон. Класификацията на такива реакции отчита промяната в степента на окисление на въглеродния атом, който е реакционният център.
Окисляването на органични съединения е процес на отстраняване на водород с образуването на множествена връзка или нова връзка между 12 С и хетероахом, по-електроотрицателен от водорода. Възстановяването е обратният процес на окисление. Редокс серията е показана с помощта на примера за последователно окисляване на метан до въглероден диоксид:
Механизмът на определена реакция на окисление или редукция може да варира значително в зависимост от природата на окислителя или редуциращия агент. Има различни начини за прехвърляне на електрони от една молекула към друга:
• директен пренос на електрони, когато метал или метален йон служи като източник на електрони (например Fe 2+ -» Fe 3+). Този метод включва окисление на свободни радикали до положителен йон или редукция на радикали до отрицателен йон, както и реакции на електролитна редукция или окисление;
• хидриден трансфер припреносът на електрони става чрез пренасяне на хидридния йон Н - от субстрата или към него. Пример за такава реакция е редукцията на алдехиди и кетони с литиево-алуминиев хидрид или натриев борохидрид;
• 1H пренос, който е свободнорадикално разцепване на R—H връзката и съответния H• пренос;
• директно взаимодействие на органичен субстрат с кислород, което води до продукт с ковалентно свързан кислород. Формален пример е алифатното хидроксилиране:
Киселинно-базови взаимодействия. Те включват широко използваните обратими реакции на йонна дисоциация:
Молекулярност на реакциите. Според броя на частиците, участващи в етапа, определящ скоростта на реакцията, органичните реакции се разделят надисоциативни(мономолекулни) иасоциативни(бимолекулни, тримолекулни). Молекулярността на реакцията се определя или от броя на частиците, подложени на разцепване и образуване на ковалентни връзки, или от броя на реагиращите видове, необходими за образуване на преходното състояние на реакцията.
Мономолекулниса процесите на разпадане на молекула на нейните съставни части или превръщането на молекула на вещество А в молекула на вещество Б. Примери за мономолекулни реакции са реакциите на нуклеофилно заместване, извършвани по механизма SN1 (вижте 13.4.2) и елиминиране по механизма Е1 (вижте 13.4.3).Бимолекулнитепроцеси са реакции на нуклеофилно заместване, протичащи по механизма SN2 (вижте 13.4.2) и елиминиране по механизма E2 (вижте 13.4.3).Тримолекулнитереакции са редки. Един пример за такива реакции е хидрохалогенирането (вижте 8.4.1).
реакционен механизъмозначава подробно описание на процеса като резултатпри които изходните материали се превръщат в крайни продукти. При изучаване на механизма на реакцията се установява как протича всеки от етапите на процеса, как се разрушават старите връзки и се образуват нови връзки, какъв е съставът и структурата на междинните частици (междинни продукти), какъв е ефектът на разтворителя (средата) върху хода на реакциите. Механизмът на реакцията трябва да е в съответствие с термодинамиката, кинетиката и стереохимията на процеса. Тя трябва да се разглежда като повече или по-малко вероятна хипотеза, обясняваща експерименталните факти. С появата на нови данни и знания за по-фините детайли на реакцията, разбирането на механизма може да се промени.