KNOW INTUIT, Лекция, Принципи на работа на електрохимичните сензори
Цел на лекцията: да се разяснят основните понятия: "електрохимичен елемент", "полуклетка", "галваничен електрод", "електроден потенциал", "йон-селективен електрод". Обяснете защо една електрохимична клетка може да се използва като сензор. Обосновете класификацията на електрохимичните сензори. Да се запознаят с методите за осигуряване и повишаване на тяхната селективност. Разкажете за принципа на определяне на концентрацията на аналитични йони с помощта на концентрационна клетка и уравнението на Нернст, за наличните в търговската мрежа йон-селективни електроди и потенциометрични сензори и техните възможности. Посочете ролята на микропроцесора в състава на интелигентните потенциометрични сензори. Обяснете принципа на действие на потенциометричните биосензори.
15.1. Принципът на действие на електрохимичен елемент
Електрохимичните сензори са, строго погледнато, един от видовете електрически сензори. Но електрическите сигнали възникват тук в системата "електронен проводник - електролит", която е склонна към химически трансформации и са толкова специфични, че обикновено се разграничават (особено от химиците) в отделен клас сензори.
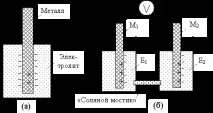
Когато електронен проводник на ток (метал, графит, електронен полупроводник) влезе в контакт с йонен проводник (йонен разтвор, стопилка, гел, кондензиран или твърд електролит) и е химически активен по отношение на него, тогава в точките на контакт възниква химическа реакция на окисление на метала, по време на която част от електроните преминават от метала към електролита (фиг. 15.1,a).
Примери за такива химични реакции:
| (15.1) |
В резултат на това металът е положително зареден, а електролитът еотрицателен, така че възниква потенциална разлика между метала и електролита. Ако електрическата верига е отворена и през системата не може да тече постоянен електрически ток, тогава динамичното равновесие се установява доста бързо: броят на електроните, които преминават от метала към електролита за единица време в резултат на директна химическа електродна реакция, се сравнява с броя на електроните, които преминават от електролита към метала под действието на потенциална разлика. В този случай възниква обратната химична електродна реакция. Потенциалната разлика, която се установява при достигане на динамично равновесие, се наричаелектроден потенциал[ [ 206 ] ].
Равновесието и следователно стойността на потенциала на електрода зависи от всички фактори, които могат да повлияят на кинетиката на химичните реакции на предния и обратния електрод:
- върху енергията на активиране на тази реакция;
- от материала, от който е направен електронният проводник;
- върху състава и концентрацията на онези йони в електролита, които могат да влязат в редокс реакции;
- върху природата на тези йони, върху тяхната подвижност;
- върху температурата на електролита и електрода;
- върху условията на дифузия и смесване;
- от наличието на източници и поглътители на участващите вещества, например от притока на вещества отвън или утаяването на реакционни продукти и др.
Електронният проводник може да бъде течен, като течен живак.
Електронният проводник може дори да е химически инертен. Важното е, че той става източник или поглътител на електрони и създава повърхност, върху която са възможни окислително-редукционни химични реакции между компонентите, присъстващи в самия електролит. Например, тези реакции:
| (15.2) |
Електродна реакция може да възникне и между електролитни компоненти и вещество, което по някакъв начин непрекъснато се доставя на повърхността на електронния проводник от външен източник. Известен пример е така нареченият "водороден електрод". Електронният токопроводник в него е платинен проводник, част от който е в тръба, пълна с водород. Водородът, който е добре разтворен в платина, дифундира по жицата и може да излезе в точките на контакт с електролита. Тогава на повърхността на платината може да протече химическа реакция
| (15.3) |
Електронен проводник в контакт с йонен проводник, ако на тяхната граница могат да възникнат окислителни или редокс химични реакции, се нарича галваничен електрод.
Галваничният електрод често се използва като елемент от сензори, които са чувствителни към някой от факторите, които значително влияят върху големината на потенциала на електрода.
Графитът най-често се използва като химически активни електронни проводници, а графитът се използва като химически инертен.
Електродният потенциал на отделен галваничен електрод не може да бъде измерен директно. Но е възможно да се измери потенциалната разлика между два или повече галванични електрода, свързани последователно.Система от два електрически свързани един към друггалванични електрода (фиг. 15.1,b)се наричаелектрохимичен елемент (илиелектрохимична клетка), а всяка от двете й съставни части също се наричаполуелементи.
В електрохимична клетка, за да се реализира обратното превключване на полуклетките,свързват електрически електролити E1 и E2. Тази връзка трябва да позволява протичането на електрически ток, но да предотвратява смесването на електролити. С други думи, трябва да позволява прехвърлянето на електрически заряди (електрони и някои йони), но да предотвратява прехвърлянето на повечето други йони, особено аналитични йони, т.е. йони, чиято концентрация трябва да се определи. Такава връзка може да бъде например пореста глинеста преграда, през която проникват електрони, но повечето йони не проникват; може да бъде стъклена или полимерна мембрана, "солен мост".
Потенциалната разлика между електродите M1 и M2 трябва да се измерва с волтметър с много високо съпротивление, така че протичането на електрически ток през него и изместването, дължащо се на това равновесие на електродните химични реакции, да могат да бъдат пренебрегнати.