Лекция #10
Електрохимията е клон на физическата химия, който изучава физикохимичните свойства на йонните системи, както и процеси и явления на повърхности, включващи заредени частици.
Проводниците на електрически ток се делят на електронни (проводници от първи вид) и йонни (проводници от втори род).
Проводници от първи вид - метали в твърдо и разтопено състояние. При тях електрическият ток се осъществява от движението на електрони от електронния газ. В този случай преминаването на електрически ток в проводници от първи вид не е придружено от химически промени в техния материал.
Проводници от втори вид - някои разтвори на соли, киселини и основи, както и някои вещества, главно соли, в разтопено състояние. Електрическият ток в тях се осъществява от движението на йони (както положителни, така и отрицателни).
Електролитите са химични съединения, които в разтвор (напълно или частично) се разпадат на йони. Дисоциацията води до разделяне, отделяне на йони от молекула или кристал в резултат на взаимодействието на йони с молекули на разтворителя.
Молекулите на разтворителя с добра дисоциираща способност са силно полярни и следователно такива разтворители имат висока диелектрична константа.
Под действието на електрически полета, създадени от електролитни йони, молекулите на полярния разтворител се привличат от йони, ориентират се около тях и на свой ред, привличайки йони към себе си, отслабват връзката между йоните.
По подобен начин те действат върху йоните, изграждащи решетката, например на йонен кристал. Броят на йоните от всеки знак се определя от стехиометричните коефициенти във формулата на електролита, подчинени на законаелектрическа неутралност - сумата от положителните заряди е равна на сумата от отрицателните. Така, въпреки наличието на йони, електролитният разтвор остава електрически неутрален.
Електростатичното взаимодействие на електролитен йон с молекулите на разтворителя - солватация - води до образуването на молекулен комплекс около йона - солват. Наборът от молекули на разтворителя, заобикалящи йона, е солватна обвивка. Солватацията във водни разтвори се нарича хидратация.
Правете разлика между силни и слаби електролити.
Силните електролити се дисоциират почти напълно в разтвор. Във водни разтвори много минерални киселини (HNO3, HC1, HC104 и др.), основи (алкали) и повечето соли са силни електролити.
Слабите електролити се дисоциират само частично в разтвор. Слабите електролити във водни разтвори включват почти всички органични киселини и основи.
Силните и слабите електролити са две различни състояния на химични съединения (електролити) в зависимост от природата на разтворителя. В един разтворител даден електролит може да бъде силен електролит, в друг - слаб.
Процесът на дисоциация на слаби електролити е обратим, тъй като йони с противоположен знак, срещащи се в разтвор, могат да се рекомбинират в молекули.
Нека разгледаме най-простия случай на слаб, силно разреден бинарен едновалентен електролит, дисоцииращ съгласно схемата
Важни характеристики на електролита:
е степента на дисоциация α е делът на дисоциираните молекули от първоначално взетите
- константа на дисоциация Kd, която за този случай може да бъде представена (използвайки закона за масовото действие - при постоянна температура скоростта на тази реакция е право пропорционална на продуктаконцентрации на реагиращи вещества, като всяка от концентрациите участва в степен, в най-простите случаи равна на коефициента пред формулата на дадено вещество в уравнението на реакцията) във вид
Например,
Ако , тогава за малки стойности на a
къдетоkeе електрохимичният еквивалент (g/C) е масата на реагиралото вещество по време на потока от 1 кулон електричество.
2-ри закон на Фарадей.Когато едно и също количество електричество преминава през различни електролити, масите на различните вещества, участващи в електродната реакция, са пропорционални на техните еквиваленти на моларна маса (Meq):
Заключение.Електрохимичната трансформация на 1 mol-eq от всяко вещество изисква същото количество електричествоF = eNA- 96485 C/mol-eq
(или 26,8 A h / mol-eq), нареченаконстанта на Фарадей.
Уравнение, което комбинира двата закона на Фарадей:
къдетоMе моларната маса на веществото,1е силата на тока,tе времето на процеса,z —е броят на електроните, участващи в електрохимичната реакция.
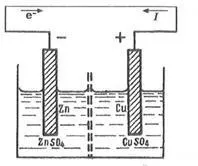
При схематично записване на електрохимични системи се използва следната нотация:
1. границата между електрода и разтвора е обозначена с вертикална плътна линия
2. Границата между електролитите е означена с две вертикални линии.
Елементът Daniel-Jacobi се състои от цинкови и медни електроди, потопени съответно в разтвори на цинков и меден сулфат, разделени от пореста диафрагма, за да се предотврати тяхното смесване.
Правилото за писане на схеми на електрохимични елементи.
ЕМП на електрохимична клетка се счита за положителна, акоелектрохимичната верига е написана по такъв начин, че по време на работа на елемента катионите преминават в разтвор от левия електрод към десния, а електроните се движат в същата посока във външната верига. Диаграма на елемента Даниел-Якоби
Когато метал се потопи в разтвор, металните йони започват да преминават във водния слой, съседен на металната повърхност под действието на силно полярни водни молекули.
В този случай приповърхностният слой на метала се изчерпва от катиони, придобива излишък на отрицателен заряд и между него и катионите в разтвора възниква потенциална разлика, която предотвратява по-нататъшното освобождаване на катиони от метала - установява се равновесие.
В елемента Даниел-Якоби цинковият електрод, който има по-висока способност да освобождава йони в разтвор от медта, придобива по-висок отрицателен заряд. Ако свържете електродите с метален проводник, тогава излишните електрони ще се прехвърлят от цинковата плоча към медната.
Това нарушава равновесието на повърхността на всеки от електродите. На цинковия електрод (отрицателният полюс на елемента - анодът) окислението на цинка продължава Zn \u003d Zn 2+ + 2e
На медния електрод (положителният полюс на елемента - катода) продължава редукцията на мед Cu 2+ + 2e
Така се осъществява спонтанен процес, при който цинковата пластина се разтваря, върху медната пластина се отделя метална мед и във външната верига протича електрически ток. Обща редокс реакция:
Cu2+ + Zn —> Cu + Zn 2+
От друга страна, ако по време на химическа реакция, z молеквивалента на вещество се отделят или разтварят на всеки електрод (според закона на Фарадей, zF C на електричество протича във външната верига), тогава максималната работа, която галваничният елемент извършва по отношение натрансфер на заряд zF между електроди с потенциална разлика E е равен на zFE.
Електродвижещата сила (ЕМС) на елемента Е е потенциалната разлика между полюсите на обратим електрохимичен елемент.
Много често е необходимо да се изчисли потенциалът при нестандартни условия; в този случай се използвауравнението на Нернст, което описва зависимостта на потенциала от концентрацията на веществото и температурата.
,
където R е газовата константа,
F е числото на Фарадей (96 500 C/mol),
T е абсолютната температура,
n е броят на електроните, участващи в процеса.
При температура от 298 K това уравнение приема следната форма:
.
където E е конвенционалния стандартен електроден потенциал на водородната скала.
За определяне на равновесния потенциал на електродана водородната скала, елементсе прави от този електрод и стандартен водороден електрод.Който е платинена нишка, потопена в
електролит, по който преминава газообразен водород, H + H2, Pt) с
активността на водородните йони в разтвора е равна на единица и налягането на водорода е равно на 1 atm. Неговият потенциал при всяка температура условно се приема равен на нула.
В този случай: стандартният водороден електрод се поставя отляво.
Например, за да се определи потенциалът на цинков електрод, се съставя електрохимична верига
Електродната реакция се записва като реакция на редукция, т.е. добавяне на електрони: в този пример, върху водорода (вляво)
електрод 2H + +2e
\u003d H2, на цинковия (вдясно) електрод Zn 2+ + 2e
= Zn. Общият отговор се записва като разликата между отговорите на десния и левия елемент
H2 + Zn 2+ = 2H + + Zn
Стандартен електроден потенциалсчита се за положителен, ако електродът е по-положително зареден от стандартния водороден електрод. В този случай електрическият ток ще тече вътре в елемента отляво надясно и ЕМП на елемента ще бъде положителна.
Потенциалът на стандартния електрод се счита за отрицателен, ако електродът е по-отрицателно зареден от стандартния водороден електрод. В този случай електрическият ток ще тече вътре в елемента отдясно наляво и ЕМП на елемента ще бъде отрицателна.
В разглеждания пример, H2 + Zn 2+ \u003d 2H + + Zn, токът в елемента ще тече от цинковия електрод към водородния електрод (отдясно наляво) и ЕМП на елемента, както и цинковият потенциал, равен на него, ще има отрицателен знак.
Стандартните електродни потенциали, определени по водородната скалапри 25 C (298 K), обикновено се подреждат в ред. Например
| Електрод | Ли + Ли | Zn 2+ Zn | H+H2, Pt | Cu 2+ Cu | F + F2, т |
| E°, V | -3.04 | -0,763 | 0,00 | +0,337 | +2,87 |
| Стандартният потенциал, разположен вдясно в електрохимичната серия, е по-електроположителен от потенциала, разположен вляво. |
| следваща лекция ==> | ||
| Наследяване на интелектуална собственост | Обобщаване на резултатите от състезанието и награждаване. |