Механизъм за образуване на разтвор
Разтворите заемат междинно положение между механични смеси от вещества и отделни химични съединения, притежаващи определени свойства на двете системи и в същото време се различават значително от всяка от тях.
Така че, в сравнение със смесите, разтворите са по-хомогенни и във всяка от техните части имат същите физични свойства и химичен състав като отделните съединения.
В същото време много вещества в разтвори, както и в механични смеси, запазват непроменени някои от свойствата, присъщи на тях в тяхната чиста форма. За разлика от отделните съединения, разтворите имат променлив състав и се различават по характера на връзката между техните структурни единици. Ако химичните вещества се характеризират с ковалентни и йонни връзки, тогава в разтворите между техните компоненти има по-слаби дипол-диполни, йон-диполни или ван дер ваалсови взаимодействия, а в някои случаи и водородни връзки и донорно-акцепторни взаимодействия.
По този начин процесът на разтваряне не може да се разглежда като просто механично разпределение на едно вещество в друго.
По време на разтварянето се осъществява физико-химичното взаимодействие на разтвореното вещество с молекулите на разтворителя, в резултат на което първоначалната му структура се разрушава и се образува нова структура, характерна за разтвора. В същото време се разграничаватфизичните и химичните етапи на разтваряне на веществото, които протичат едновременно.
D
Наистина велик учен. Изглежда няма област от химията, в която той да не е допринесъл. Най-известните му произведения, в допълнение към периодичния закон, са откриването на "абсолютната точка на кипене" (критична точка),развитие на физикохимичната (хидратна) теория на разтворите, формулиране на обобщения закон за газа. Д. И. Менделеев смята учебника „Основи на химията“ за друго основно дело на живота си.
На физическия етап протича процесът на смилане (диспергиране) на разтвореното вещество в отделни молекули или йони и равномерното им разпределение в целия обем на разтвора. Осъществява се поради действието на молекулите на разтворителя върху веществото и хода на процеса на дифузия.
На този етап винаги се изразходва енергия, т.к. необходимо е да се разрушат връзките в кристалната решетка на твърдото вещество или междумолекулните връзки, когато течността се разтвори.
Нека покажем механизма на този процес, като използваме примера за разтваряне на сол KCl в H2O, която има йонна кристална решетка (фиг. 18).
Диполите на разтворителя са ориентирани по подходящ начин спрямо йоните на кристалната решетка на повърхността му и в резултат на топлинното им движение и вибрационното движение на йоните последователно ги изтръгват от възлите на решетката и ги пренасят в разтвор.
Колкото по-силни са връзките в кристалната решетка, толкова повече енергия трябва да се изразходва за нейното разрушаване. Междумолекулните връзки в течностите като правило са по-слаби, отколкото в твърдите вещества, така че при разтварянето им се изразходва много по-малко енергия. В газовете молекулите практически не са свързани помежду си, поради което не се изразходва енергия на физическия етап на тяхното разтваряне.
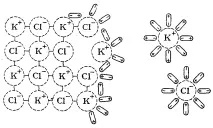
Ориз. 18. Механизмът на разтваряне на йонно съединение (KCl) във вода
На химичния етап на разтварянеразтворените частици (молекули или йони) взаимодействат с молекулите на разтворителя и се образуват химични съединения:хидрати(ако H2O действа като разтворител) илисолвати(акоразтворителят е всяка друга течност).
В зависимост от естеството на разтвореното вещество солватите (хидратите) могат да се образуват в резултат на физически взаимодействия: йонно-диполни (когато се разтварят вещества с йонна структура) и дипол-диполни (когато се разтварят вещества с молекулярна структура) и химични.
Химичните взаимодействия се осъществяват чрез образуване на донорно-акцепторни връзки. В този случай йоните на разтвореното вещество са акцептори, а молекулите на разтворителя (Н2О,NH3) са донори на електронни двойки. Така образуваните хидрати се наричат иначеаква комплекси: [Cu(H2O)6] 2+, [Al(H2O)6] 3+. Образуването им в разтвори често е придружено от промяна на цвета. Така разтварянето на безводен бял меден (II) сулфат води до появата на интензивен син цвят. Хидратационните обвивки на полярните молекули на органичните съединения се появяват в резултат на образуването на водородни връзки между техните функционални групи и водните молекули.
Поради образуването на хидрати (солвати), при разтваряне на много вещества,свиване-компресия на обема на системата поради нейното самоуплътняване (особено при концентрираните разтвори). В този случай обемът на получения разтвор ще бъде по-малък от сумата на обемите на разтворителя и разтвореното вещество (освен ако последното не е газ).
Образуването на хидратни (солватни) черупки винаги е придружено от освобождаване на енергия. Когато йоните са хидратирани, количеството освободена енергия и броят на задържаните водни молекули зависят от техния заряд и радиус.
Колкото по-голям е зарядът на йона и колкото по-малък е неговият радиус, толкова по-голямо е количеството освободена енергия и толкова по-стабилна ще бъде получената хидратна обвивка (фиг. 19).
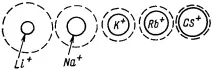
Ориз. 19. Зависимост на размерите на хидратните обвивки на йони от стойността на техния радиус
Ако веществото в разтвор е под формата на молекули, тогава количеството енергия, освободено по време на хидратацията, е пропорционално на полярността на неговите молекули.
В хода на топлинното движение частиците на разтвореното вещество в разтвора се движат заедно с техните хидратни (солватни) обвивки, които са едно цяло с тях.
В повечето случаи получените хидратни (солватни) черупки са крехки и лесно се разрушават още при слабо нагряване или когато веществата изпадат от разтвора. Но понякога хидратираните съединения са толкова стабилни, че изпадат от разтвора под формата на кристали, които иначе се наричат кристални хидрати, а съдържащата се в тях H2O екристализация.
В химичните формули на кристалните хидрати молекулите на H2O се изписват с точка (Таблица 5). Тези формули показват колко молекули H2O обграждат една молекула от веществото.
Таблица 5.Формули и тривиални имена на кристални хидрати