митохондрии - митохондрии
Митохондриална дисфункция при нефропатии при деца (Преглед на литературата)
Московски научноизследователски институт по педиатрия и детска хирургия, Министерство на здравеопазването на Руската федерация, Москва Адрес за кореспонденция: Москва, ул. Талдомская, 2. Московски научноизследователски институт по педиатрия и детска хирургия, МЗ България Телефон: 483-21-92
Ключови думи: митохондриални заболявания, бъбрек, диагностика, лечение
Постиженията на медицинската наука в областта на биохимията, клиничната морфология и медицинската генетика през последните десет години позволиха да се идентифицира нов разнороден слой от наследствени заболявания при деца, причинени от нарушение на структурата и функциите на митохондриите и в резултат на това енергиен дефицит на клетките. Митохондриалните нарушения са широка група от патологични състояния, свързани с дефекти в митохондриалния или ядрения геном [31]. Биохимичните промени, причинени от митохондриални дефекти, се проявяват чрез нарушен транспорт на митохондриални субстрати, патология на използването на субстрата, дефекти в дихателната верига и недостатъчно натрупване и пренос на енергия [24]. Списъкът на митохондриалните заболявания непрекъснато нараства през последните години. Известни са най-малко 15 форми на заболявания, свързани с наследствени нарушения на транспорта и окислението на мастни киселини, и е доказан значителният им принос за възникването на хипогликемични състояния при деца, синдром на внезапна смърт [14]. Митохондриалните заболявания са трудни за диагностициране поради неспецифичността на отделните клинични прояви и изискват разработване и прилагане на нови диагностични програми, базирани на клинични, биохимични, молекулярно-генетични и морфологични критерии.
Той за пръв път наблюдава митохондрии под формата на гранули в мускулни клетки на Келикер през 1850 г. По-късно, през 1898 г., Миксаелис доказва, чеМитохондриите играят важна роля в редокс процесите и клетъчното дишане. От 30-те години на 19 век започва активно изследване на структурата и функциите на митохондриите: описана е системата на цитохромите и окислителното фосфорилиране, Г. Кребс разработва концепцията за цикъла на трикарбоксилната киселина. Нов пробив в морфологичните и цитогенетичните аспекти на изследването на митохондриите е направен през 60-те години на миналия век, когато са открити митохондриалният геном и митохондриалната ДНК. Възниква теория за произхода на митохондриите: предполага се, че в процеса на филогенезата митохондриите като бактерия-симбионт са интегрирани в клетката. През 1963 г. Engel и Cunningham описват морфологичния субстрат на митохондриалното увреждане - "разкъсани" червени влакна. В същото време R. Luft описва пациент с нетиреоиден хиперметаболизъм, който има нарушение на процесите на окислително фосфорилиране. Авторът е първият, който доказва пряка връзка между митохондриален дефект и появата на патологични клинични прояви. Последващите изследвания от XX-XXI век бяха насочени към описание на клиничните симптоми и идентифициране на нови нозологични форми на митохондриални заболявания. По-нататъшни изследвания на структурата и функциите на митохондриите бяха извършени с помощта на най-новите технологии. С въвеждането на методите на молекулярната генетика в клиничната практика е създадена генетична карта на митохондриалните заболявания. Това послужи като основа за разработването на нови диференцирани патогенетични подходи към терапията.
Структурни и функционални характеристики на митохондриите
Митохондриите са вътреклетъчни органели, които произвеждат АТФ и съдържат уникален геном, унаследен главно по майчина линия (не-менделско наследяване) [79]. Митохондриите се съдържат в цитоплазмата на всички аеробни еукариотни клетки [4]. отСпоред електронната микроскопия типичната митохондрия има формата на къс извит цилиндър със заоблени краища. Дължината му е около 1,5 микрона, диаметърът е 0,5 микрона. Митохондриите имат двуслойна мембрана: външната мембрана образува гладка повърхност, върху нея са концентрирани ензими, участващи в транспорта и активирането на мастни киселини. Многобройни гънки-кристи се отклоняват от вътрешната мембрана, където са фиксирани комплекси от ензими, участващи в преноса на електрони и окислителното фосфорилиране (комплекс от цитохроми B, C, A, A3) (фиг. 1).
Фиг. 1. Структурата и работата на митохондриите:
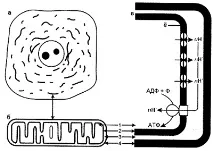
а - митохондрии (обозначени със стрелка), видими в светлинен микроскоп;
b - ултраструктура на митохондриите: 1 - митохондриална матрица, 2 - вътрешна митохондриална мембрана, 3 - междумембранно пространство, 4 - външна митохондриална мембрана;
в - обща схема на функциониране на митохондриите: когато електроните се прехвърлят в окислителната верига, протоните се натрупват в междумембранното пространство и при достигане на определен потенциал се връщат в матрицата; енергията на този потенциал се изразходва за синтеза на АТФ
Има доказателства, че в клетките се образуват и функционират интегрирани системи от митохондрии, които осигуряват енергия на тъканите [1].
Основната функция на митохондриите е аеробно биологично окисление (тъканно дишане), по време на което се освобождава енергия и протоните се прехвърлят към свободните кислородни радикали с образуването на вода [11]. Друга важна характеристика на човешкия и животинския организъм е способността да акумулира освободената енергия под формата на високоенергийни съединения (АТФ, креатин фосфат и др.). Натрупаната енергия впоследствие се трансформира в механична (в мускулните клетки), биоелектрическа (в нервните клетки),енергия на активния транспорт (в клетките на тубуларния епител на бъбреците).
Неразделно свойство на биологичното окисление е конюгирането на тъканното дишане и окислителното фосфорилиране [11]. Установено е, че някои компоненти на дихателната верига (коензим Q, цитохромоксидаза), заедно с преноса на електрони по веригата, извършват и пренос на протони от митохондриалната матрица към междумембранното пространство, което води до образуването на протонен градиент. В процеса на обратния поток на протони в митохондриалната матрица, енергията, освободена в дихателната верига, се използва чрез фосфорилиране на АДФ до АТФ и други високоенергийни фосфати и се създава резерв от енергия за биологично окисление. В допълнение към електронния транспорт, окислителното фосфорилиране, митохондриите осигуряват друг процес, включващ редокс реакции - β-окисление на мастни киселини. Свободните мастни киселини се превръщат в ацетил-КоА и след това в естери с карнитин. Карнитин-ацетил-КоА се транспортира през митохондриалната мембрана, ацетил-КоА се освобождава и участва в β-окислението.
Важна функция на митохондриите е също така да контролират синтеза на група транспортни и рибозомни РНК.
Митохондриалната ДНК е малка двуверижна молекула, състояща се от тежка и лека верига, съдържаща 16569 базови двойки, 37 гена и притежаваща собствена машина за репликация [65]. Повечето митохондриални протеини са кодирани от ядрена ДНК и само 2% се синтезират в митохондриалната матрица под контрола на структурни гени. 13 гена са отговорни за полипептидите на дихателната верига: 7 принадлежат към комплекс I, 1 към комплекс III, 3 към комплекс IV, 2 към комплекс V. Митохондриалната ДНК също кодира 22 трансферни РНК и 2 рибозомни РНК (12s,16s). Останалите 70 полипептида, които съставляват I–V комплекса, са кодирани от ядрени гени, транспортирани до митохондриите и функционират там [26].
Почти всяка клетка включва стотици и хиляди митохондрии, всяка от които съдържа от 2 до 10 митохондриални ДНК молекули [38]. Причините, водещи до мутации в митохондриалната ДНК, могат да бъдат доста разнообразни. Едни от най-честите – ендогенни – грешки са във функционирането на ДНК полимерази и репарази (ензими за синтеза на митохондриалния геном) [8]. Друг механизъм на мутация е увреждане на митохондриалния геном, незащитен от хистони и нитрони от продукти на пероксидация (супероксидни радикали, водороден пероксид, хидроксилни радикали), тъй като митохондриите използват до 90% от клетъчния кислород. Митохондриалните ДНК мутации са делеции с различни размери (включително множество), точковидни лезии, изчерпвания и вмъквания. Репликацията на митохондриалната ДНК е много интензивна (10 пъти по-бърза от ядрената) и мутациите се натрупват бързо. Много фактори на околната среда (хипоксия, упражнения, йонизиращо лъчение) и лекарства също играят роля в патогенезата на митохондриалните мутации.
Митохондриалните нарушения могат да възникнат от аномалии или в ядрото, или в митохондриалния геном. В резултат на това може да се получи всякакъв вариант на наследяване: автозомно доминантно, автозомно рецесивно, Х-свързано, наследство по майка, спорадични случаи. Прехвърлянето на митохондриите и митохондриалната ДНК към следващото поколение в по-голямата част от случаите става през цитоплазмата на яйцеклетката [36].
Наличието на голям брой копия на митохондриална ДНК във всяка клетка и произволното им разпределение по време на клетъчното делене определятфеномен на хетероплазмия. Когато нормалният или мутантен геном на всички митохондрии е идентичен, клетката се счита за хомоплазмена. В присъствието на мутантна митохондриална ДНК, способността на клетките да извършват окислително фосфорилиране се определя от естеството на мутацията, съотношението на нормалните и мутантните геноми. Превишаването на нормалния праг на функциониране е придружено от нарушение на енергията и появата на клинични нарушения. Праговият ефект зависи от различни фактори, включително възрастта и енергийните нужди на тъканта. Феноменът на хетероплазмената клетка обяснява наблюдението, че симптомите на увреждане на един или друг орган могат да се увеличат или намалят в процеса на наблюдение, докато първоначално незасегнатите органи могат да бъдат включени в патологичния процес.
Броят на митохондриите се контролира чрез автофагия. Старите, "износени" митохондрии се унищожават от лизозомите. Ако по някаква причина броят на митохондриите стане по-малък от необходимия и производството им на АТФ намалее, тогава в клетката се включват други механизми за получаване на енергия, като например процесът на гликолиза в цитоплазмата с производството на малко количество АТФ и увеличаване на производството на млечна киселина [15].
Таблица 1. Структурни и функционални характеристики на комплексите на дихателната верига