Натриев перхлорат
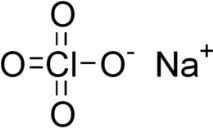 |
 |
| Натриев перхлорат |
| PCN |
| NaClO4 |
| 122,45 g/mol |
| безводна сол: 2,4994 g/cm3 монохидрат: 2,02 g/cm3 |
| монохидрат: 130 °C |
| безводна сол: 468 °C |
| 211 25; 330 100 гр./100 мл |
| 1,4617 (nD) |
| 7601-89-0 |
| 522606 |
| 231-511-9 |
| SC9800000 |
| 132103 |
| 1502 |
| 22668 |
| Данните се основават на стандартни условия (25 °C, 100 kPa), освен ако не е отбелязано друго. |
Натриевият перхлорат(същоPCN) е химичното съединение NaClO4, натриевата сол на перхлорната киселина. Силен окислител. При кристализация от водни разтвори при температури над 51 градуса по Целзий се утаява безводна сол, под 51 градуса по Целзий NaClO4 H2O монохидрат, а под -13 градуса - дихидрат. Както безводната сол, така и кристалните хидрати са много хигроскопични, така че натриевият перхлорат се използва главно като суровина за производството на други перхлорати чрез обменни реакции.
Съдържание
Главна информация
Безцветно кристално вещество с орторомбична структура. Молекулно тегло 122,45 a.u. м. Много добреразтворим във вода - повече от 209,6 g на 100 g вода при 25 градуса по Целзий [1] . Разтворете добре и в етилов алкохол.
При нагряване до 482 °C се разлага.
Химични свойства
Натриевият перхлорат като окислител може да взаимодейства с широк спектър от горими вещества, например с глюкоза:
3 N a C l O 4 + C 6 H 12 O 6 → 6 C O 2 + 6 H 2 O + 3 N a C l +C_H_O_\rightarrow 6CO_+6H_O+3NaCl>>>
Натриевият перхлорат може да бъде направен по няколко различни начина, включително:
- Термично диспропорциониране на натриев хлорат:
- Електролитно окисляване на натриев хлорат върху платинов анод.
- Реакцията между перхлорна киселина и натриев хидроксид или карбонат.
В промишлеността вторият метод сега се използва почти изключително.
Приложение
Преди това натриевият перхлорат се използва като хербицид. Дори малка добавка от него в чилийската селитра причинява смъртта на пшеницата и някои други култивирани растения. Сега натриевият перхлорат практически не намира самостоятелна употреба, но отличната му разтворимост във вода прави възможно получаването на перхлорати на всякакви метали, амоний от него:
N a C l O 4 + N H 4 C l → N H 4 C l O 4 + N a C l +NH_Cl\rightarrow NH_ClO_+NaCl>>>
В допълнение, чрез третиране на натриев перхлорат със сярна киселина може да се получи свободна перхлорна киселина.
N a C l O 4 + H 2 S O 4 → N a H S O 4 + H C l O 4 + H_SO_\rightarrow NaHSO_+HClO_>>>
Токсичност
Информацията за токсичността на натриевия перхлорат при животни е противоречива. В същото време е очевидно, че поради по-голяма стабилносттетраедричните анионни перхлорати са по-малко токсични от хлоратите, хлоритите и хипохлоритите. Въпреки това, когато се погълне, натриевият перхлорат силно нарушава натриево-калиевия баланс, тъй като калиевият перхлорат е почти неразтворим във вода (и в биологични течности) при обикновени температури.
При гризачи (плъхове, мишки, морски свинчета) натриевият перхлорат предизвиква повишаване на рефлексната възбудимост, конвулсии и тетанус, често с опистотонус. Тези симптоми се наблюдават в рамките на 10 минути след подкожно приложение на 0,1 g натриев перхлорат на плъхове, а след приложение на 0,22 g плъховете умират след 10 часа.