Обща характеристика на електролитите
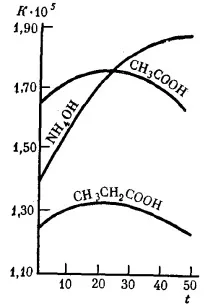
Ориз. 31. Зависимост на константата на дисоциация K на някои слаби електролити във водни разтвори от температурата t (°C)
Колкото по-малък е Kdiss., толкова по-слаб е този електролит. Например оцетната киселина (Kdiss.= 1,85 10–5) е почти 220 000 пъти по-силна от циановодородната HCN (Kdiss.= 4,8 10–10) и около 10 пъти по-слаба от мравчената киселина (Kdiss.= 1,8 10–4).
Има слаби електролити (многоосновни киселини, поликиселинни основи), процесът на разлагане на които в йони протича стъпаловидно, т.е. на няколко етапа. В този случай всеки етап се характеризира със своята стойност на константата на дисоциация.
Например, в етап 2 се извършва дисоциацията на хидросулфидна киселина:
1) H2S H + + HS –
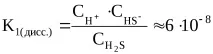
2) HS - H + + S 2 -
Общото уравнение за реакцията на дисоциация на H2S е както следва:
H2S2H + +S 2–
Стойността на константата на дисоциация за общото уравнение и стойностите на константите на дисоциация на отделните етапи са свързани помежду си чрез връзката:
При поетапна дисоциация, разлагането на слаб електролит на всеки следващ етап се извършва в по-малка степен, отколкото в предишния, т.е. 4>3и т.н. Това се обяснява с факта, че отделянето на йона вече не става от неутрална молекула (както в първия етап), а от частица с непрекъснато нарастващ заряд и следователно изисква големи разходи на енергия.
Често, за да се оцени силата на слаб електролит, вместо стойността на константата на дисоциация се използва неговият десетичен логаритъм, взет с противоположния знак (pK)
В този случай, колкото по-голяма е стойността на pK, толкова по-слаб е електролитът.
Слаба степен на електролитна дисоциациянамалява, ако към неговия разтвор се добави силен електролит, дори и в малко количество, съдържащ йони със същото име в състава си.
Например, ако натриев ацетат CH3COONa се добави към разтвор на CH3COOH, тогава концентрацията на CH3COO ацетатни йони ще се увеличи рязко поради дисоциацията на солта. В съответствие с принципа на Льо Шателие, това ще доведе до промяна в равновесието на реакцията
CH3COOHCH3COO – + H +
наляво. Подобен ефект се наблюдава, ако малко количество силна киселина се добави към разтвор на CH3COOH.
По този начин дисоциацията на слаба киселина се потиска в присъствието на собствена сол или силна киселина. Същото може да се каже и за слаба основа, чиято дисоциация ще бъде потисната в силно алкална среда или в присъствието на сол, съдържаща едноименния катион.
Когато се добави голямо количество подходящо силен електролит, слабият електролит трудно ще се дисоциира.
Съществува количествена връзка между степента на дисоциация на слаб електролит и концентрацията му в разтвор, нареченаЗакон за разреждане на Оствалд.
За бинарен електролит, чиито молекули се разлагат само на 2 йона, може да се покаже, че
където С е началната моларна концентрация на електролита в разтвора; α е степента на електролитна дисоциация; C ∙ α е концентрацията на разградените електролитни молекули и получените йони.
W
Роден в Рига. Учи в Дорпатския университет, където през 1878 г. получава докторска степен. От 1882 г. е професор в Рижкия университет. От 1887 г. се премества в катедрата по физикохимия в Лайпциг, където работи до 1928 г.
В. Оствалд изследва електропроводимостта на органичните киселини.След като се запознава с произведенията на С. Арениус, той става негов поддръжник. W. Ostwald направи значителен принос в теорията на електролитната дисоциация. По-специално, той предложи своя добре известен закон за разреждане, показа, че аналитичните реакции в разтворите трябва да се считат за йонни и обясни цвета на разтворите на много вещества със специфичния цвят на йоните. W. Oswald също притежава изследвания върху катализата.
Тъй като степента на дисоциация на слабите електролити е малка, тази стойност в знаменателя може да бъде пренебрегната. Тогава K=C·α 2, откъдето
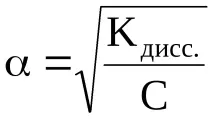
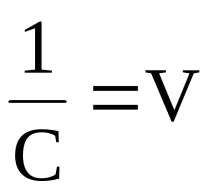
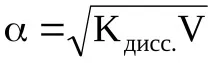
За електролити, чиито молекули или формулни единици се разпадат на по-голям брой йони, законът за разреждане на Оствалд е по-сложен.
Калкулатор
Услуга за безплатна оценка на цената на работата
- Попълнете заявление. Експертите ще изчислят цената на вашата работа
- Изчисляването на цената ще дойде по пощата и SMS
Номерът на вашето приложение
Точно сега по пощата ще бъде изпратено автоматично писмо за потвърждение с информация за приложението.