Определяне на истинските формули на химичните съединения по процентен състав и молекулно тегло
Количественият състав на химичното съединение позволява да се изчисли съотношението на броя на атомите на отделните елементи, които образуват молекулата на дадено съединение, но не казва нищо за истинския брой на тези атоми. И така, въз основа на състава на съединение, съдържащо 2,24% водород, 26,68% въглерод, 71,08% кислород, откриваме, че броят на Н, С и О атомите в неговата молекула се отнасят един към друг като
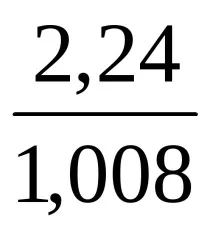
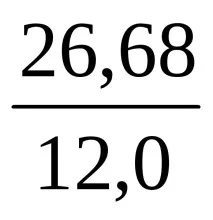
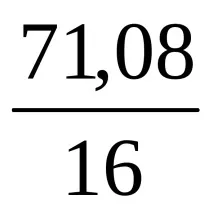
Това съотношение съответства както на формулата HCO2, така и на формулите H2C2O4, H3C3O6 и др. За да се направи заключение за истинската формула на химичното съединение, е необходимо да се определи неговото молекулно тегло. Ако се окаже, че е равно на 90, тогава проблемът ще бъде решен в полза на формулата H2C2O4.
Молекулното тегло на химичното съединение в състояние на газ или пара може да се съди по неговата плътност. Както вече беше споменато, от закона на Авогадро следва, че масите на равни обеми от различни газове, взети при едни и същи условия, са свързани една с друга като техните молекулни тегла. Но съотношението на тези маси е число, показващо колко пъти един газ е по-тежък или по-лек от друг, тоест плътността на един газ по отношение на втория, взета за сравнение:
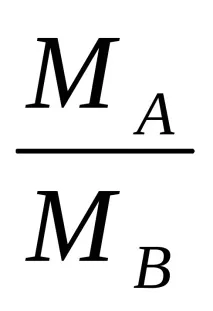
където MA и MB са молекулните тегла на газовете A и B, а D е плътността на газ A спрямо газ B. Следователно
Определяйки моларната маса Mx на определено вещество въз основа на неговата водородна плътност DH, можем да използваме следния израз:
За изчисления, които не изискват голяма точност, този израз се чете, както следва:молекулното тегло на веществото в газообразно или парообразно състояние е равно на двойната му плътност във водород.
Ако вземем за сравнение кислород или въздух, тогава
където Dk и Dair са плътностите на изпитваното вещество по отношение на кислород и въздух, и 29- средното молекулно тегло на въздуха (масата на 22,4 литра въздух при 0 ° C и 101,3 kPa е 29 g).
Пример. Съединението съдържа 82,64% въглерод и 17,36% водород. Плътността му във водород е 28,8. Намерете истинската формула на съединението.
Решение
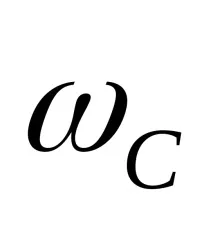
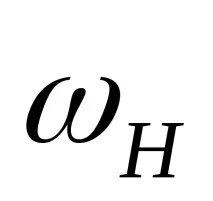
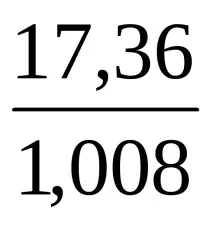
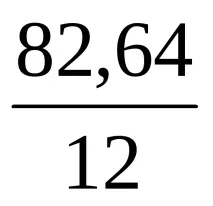
DH \u003d 28,8 Mx \u003d 2,016 ∙ 28,8 \u003d 58 g / mol
Отговор. Най-простата формула съответства на състава на C2H5. Молекулното тегло на съединението е 58 g/mol. Следователно истинската формула съответства на състава C4H10.
76. Някои съединения съдържат 75,76% As и 24,24% O. Неговата плътност на парите във въздуха е 13,65. Намерете истинската формула на съединението. Каква ще бъде неговата формула, ако с повишаване на температурата плътността на парите намалее наполовина?
77. Съединението съдържа 45,15% въглерод, останалото е азот. Плътността на въздуха е 1,79. Намерете истинската формула на съединението.
78. Съединението съдържа 24,26% С, 71,62% Cl и 4,12% Н. Плътността на водорода е 49,1. Намерете истинската формула на съединението.
79. Комбинацията от бор с водород съдържа 78,18% бор, останалото е водород. Плътност на водорода 13,71. Намерете истинската му формула.
80. Комбинацията от бор с флуор съдържа 84,04% F. Плътност на въздуха 2,34. Намерете истинската формула.
81. Комбинацията от водород с арсен съдържа 3,85% H. Плътност на въздуха 2,7. Намерете истинската формула.
82. Флуороводородът съдържа 95% флуор. При определена температура неговата плътност на водородните пари е 20. Каква е истинската формула за флуороводорода? Какъв ще бъде съставът на молекулата, ако плътността достигне 10 с повишаване на температурата?
83. Някои съединения съдържат 54,50% въглерод, 36,34% кислород, останалото е водород. Плътност на въздуха 3,04. Намерете истинатаформула.
84. Комбинацията от въглерод и водород съдържа 92,26% въглерод, останалото е водород. 0.195 g от това съединение заема обем от 61.5 ml при 27°С и 101.3 kPa. Каква е истинската формула на съединението?
85. Съединението на сярата с флуор съдържа 62,8% S и 37,2% F. Масата на 118 ml от това съединение под формата на газ, измерена при 7 o C и 98,64 kPa, е 0,51 g. Каква е истинската формула на съединението?
86. При изгаряне на определено съединение на азот с водород се получават 0,27 g H2O и 168 ml азот от 0,24 g вещество (при 0 o C и 101,3 kPa). Плътността на парите на азотсъдържащото вещество във въздуха е 1,1. Каква е истинската формула на веществото?
87. Масовите части на сярата и кислорода в серен оксид са съответно 40 и 60%. Определете най-простата формула за този оксид.
88. Масовата част на хлора във фосфорния хлорид е 77,5%. Определете най-простата формула за хлорида.
89. Съставът на химичното съединение включва натрий, фосфор и кислород. Масовите фракции на елементите са (%): натрий - 34,6, фосфор - 23,3, кислород - 42,1. Определете формулата на най-простото съединение.
90. Някои киселини съдържат водород (масова част 2,2%), йод (55,7%) и кислород (42,1%). Определете най-простата формула на тази киселина.
91. В молибденовия оксид съотношението на масата на молибдена към масата на атомарния кислород е 2. Определете най-простата формула за оксида.
92. Проба от съединение на фосфор и бром с тегло 81,3 g съдържа фосфор с тегло 9,3 g. Определете най-простата формула на това съединение.
93. Моларната маса на съединението на азота с водорода е 32 g / mol. Определете формулата на това съединение, ако масовата част на азота в него е 87,5%.
94. Определете най-простата формула за съединението на алуминий с въглерод, ако е известно, че масовата част на алуминия в негое 75%.
95. Определете най-простата формула за съединението на калий с манган и кислород, ако масовите части на елементите в това вещество са съответно 24,7, 34,8 и 40,5%.
96. При изгаряне на 0,1 mol от някакво просто вещество се образува 0,1 mol оксид, масовата част на кислорода, в която е 43,6%. Плътността на парите на това вещество във въздуха е 7,6. Задайте молекулната формула на изгореното вещество и получения оксид.
97. При изгарянето на метал с тегло 3 g се образува неговият оксид с тегло 5,67 g. Степента на окисление на метала в оксида е +3. Какъв е този метал?
98. При разлагането на 21 g двувалентен метален карбонат се отделят 5,6 литра въглероден оксид (IV) (при n.a.). Задайте формулата на солта.
99. Определете най-простата формула на вещество, ако е известно, че молната част в него е Ag = 7,69%, N = 23,08%, H = 46,15%, O = 23,08%.
100. Определете най-простата формула на оксаловата киселина, ако е известно, че 20 g от тази киселина съдържат 0,444 g водород, 5,33 g въглерод, останалото е кислород.