Основните видове метална корозия
Според характера на разпределението на щетите се разграничава равномерна корозия (фиг. 3), когато цялата повърхност на метала или сплавта е увредена от корозия приблизително в еднаква степен.
При равномерна корозия способността на метала да издържа на агресивните въздействия на околната среда може да се оцени чрез определяне на скоростта на корозия, измерена чрез загубата на метал (т.е. количеството метал, което се е превърнало в химическо съединение - продукт на корозия) на единица повърхност за единица време.
Неправилната корозия (фиг. 4) може да бъде под формата на изолирани петна или дълбоки лезии, наречениязви, ако засягат само малка част от повърхността. Ако процесът на корозия се простира дълбоко в метала, тогава корозията се наричапитинг(от английската думаpit- задълбочаване).
Много опасен вид неравномерна корозия емеждукристална корозия, която се характеризира с разрушаване на метала по границите накристалити, които определят структурата на метала. Размерът на загубите при този вид корозия може да бъде незначителен, докато механичната якост на метала е значително намалена. Някои стомани, месинг, бронз и други медни сплави са податливи на междукристална корозия.
Класификация на корозионните процеси
Според условията на преминаване и характера на агресивната среда се разграничават химическа и електрохимична корозия.
Химическа корозия
Химическата корозия е разрушаването на метал поради окисляването му от вещества, съдържащи се в околната среда, без появата на електрически ток в системата в съответствие с уравнението в обща форма:
Според условията на протичане на корозионния процес (естеството на агресивната среда) има:
а)газова корозия- в газове и пари безкондензация на влага върху метална повърхност, обикновено при високи температури. Пример за газова корозия е окисляването на метал от атмосферен кислород при високи температури.
nMe + O2 = MenOm,
или в среда на различни агресивни газове. Например в йодна среда на медната повърхност протича редокс реакция:
2 │Cu – 1ē→ Сu + окисление
1 │I2 + 2ē→ 2I – възстановяване.
б)корозия в неелектролити- агресивни органични течности, като кисело масло и др.
Кинетика на химическата корозия. Скоростта на химическата корозия зависи основно от свойствата на получените продукти от корозия. По време на процеса на окисляване върху металната повърхност се образува твърд филм от оксиди. За по-нататъшно продължаване на корозията е необходимо металните йони или кислородът (или и двете) да дифундират през този филм. Обикновено от границата метал-оксид в посока от метала към външната повърхност на филма се получава дифузия на метални йони, а не на атоми, тъй като металните йони са по-малки от атомите по размер. В същото време електроните трябва да се движат в една и съща посока. O 2– йони имат по-голям радиус от атомите, следователно не йони, а кислородни атоми се движат от интерфейса оксид-газ в дълбочината на филма, които се йонизират във филма:
и при среща с метални йони образуват оксиди.
За алкални и алкалоземни металисе наблюдава линеен закон за нарастване на дебелината на филма с течение на времето:
къдетоyе дебелината на филма,kе константа в зависимост от природата на метала,tе времето на окисление.
С повишаване на температурата реакцията на окисление на такива метали започва рязко да се ускорява поради лошото отстраняване на топлината.
За Fe метали,Co, Ni, Mn, Tiтъй като филмът се удебелява, по-нататъшният му растеж ще се забавя през цялото време. Растежът на филма за тези метали се характеризира с параболична зависимост и се описва с израза:
къдетоDе коефициентът на дифузия;CO2—концентрация на кислород.
За метали Zn, Al, Crе установена логаритмична зависимост на растежа на филма във времето:
къдетоkе константа в зависимост от природата на метала. Филмите върху такива метали имат високи защитни свойства.
Електрохимична корозия
Електрохимичната корозия е спонтанен редокс процес на разрушаване на метали и сплави под въздействието на външни фактори, при който, за разлика от химическата корозия, има насочено движение на електрони от окисления метал към окислителя.
Електрохимичната корозия възниква, когатодва метала с различна активност влязат в контакт. Разликата в енергиите на йонизация и афинитета на електроните кара електроните да се преместват от по-активен метал към по-малко активен, което задейства процеса на електрохимична корозия.
Механизмът на електрохимичната корозия. Процесите на електрохимична корозия протичат съгласно законите на електрохимичната кинетика, когато общата реакция на взаимодействие може да бъде разделена на следните процеси:
1) аноден процес - преходът на окислени метални йони в разтвор, придружен от хидратация (солватация):
2) омичен процес - потокът на освободените електрони от анода към катодните секции и движението на йони в разтвора;
3) катоден процес - асимилация на електрони от някакъв окислител, в този случай настъпва катодна редукция на окислителя Ox:
Окислители по време на корозия са кислородни молекули O2, хлорCl2, H + йони, Fe 3+, NO3 - и др. Най-често при корозияв неутрална и алкална среда се наблюдава намаляване на кислорода:
ив кисела среда - отделяне на водород:
Корозия, включваща молекулярен кислород, се нарича корозия скислородна деполяризация. Корозията, включваща водородни йони, се нарича корозия сводородна деполяризация.
В допълнение към електрохимичните реакции по време на корозия обикновено възникват вторични химични процеси, например взаимодействието на получените метални йони с хидроксидни йони, чиято концентрация се увеличава в резултат на катодни реакции:
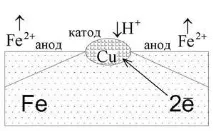
Например, ако желязото е в контакт с мед в атмосфера на влажен въздух (фиг. 5), тогава по-малко активният метал мед действа като катод, върху който окислителят се редуцира и материалът на анода се окислява. Появява се галванична двойка, по време на работата на която протичат следните процеси:
анод Fe 0 – 2ē→ Fe 2+ ;
Провеждат се допълнителни вторични процеси:
Полученият железен (II) хидроксид лесно се окислява от атмосферния кислород, което в крайна сметка води до образуването на ръждаmFe2O3·nFeO·pH2O.
Образуването на галванична клетка (галванична двойка) от два метала с различна активност води до корозия, която е по-силна, отколкото при оригиналния активен метал. Например, цинкът в разтвор на солна киселина (E0 Zn2+ / Zn 0 \u003d - 0,762 V) реагира с отделяне на водород:
или в йонна форма:
Zn + 2H + = Zn 2+ + H2↑;
но постепенно се изолира от разтвора чрез малки мехурчета от получения газ, в резултат на което по-нататъшното му разтваряне спира.
Медта не реагира с разредена солна киселина, тъй като е в поредица от напрежения след водорода,стандартен електроден потенциалE0 Cu2+ / Cu 0 \u003d +0,34 V. Но цинкът в контакт с мед образува корозивна галванична двойка в разредена солна киселина:
В кисела среда се наблюдава електрохимична корозия на Zn с водородна деполяризация, при която ролята на анода се играе от по-електроотрицателен (по-активен) метал, цинк, т.к.
По време на корозия цинкът се разтваря:
анод: Zn – 2ē→ Zn 2+ (окисление);
омичен процес - преходът на електрони от анода към катода:
Zn 2eCu;
катод: 2H + + 2ē→ H2 (върху медна повърхност).
Продуктът на корозия в кисела среда е цинков хлорид:
Zn 2+ + 2Cl - = ZnCl2.
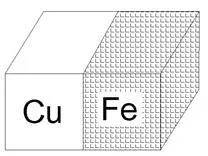
Много често електрохимичната корозия възниква, когато металът съдържа включвания на метал с по-малка активност или неметални, но в същото време проводими включвания (както например се случва в стоманата, където има много включвания на железен карбид FeC3), които стават катодни области на електрохимична корозия.
Като пример, разгледайте желязото, което съдържа медни включвания като примес (фиг. 6). Цялата конструкция се потапя в разреден разтвор на солна киселина HCl. На медната повърхност окислителят се редуцира, а анодният материал се окислява и разтваря:
Електрохимична корозия и ЕМП на галванична двойка. Възможността за корозия може да се установи по знака на ЕМП на получената галванична клетка. Ако EMF > 0, тогава е възможна корозия. EMF е равна на потенциалната разлика между окислителя и редуктора (катод и анод), така че е възможна корозия, при условие че потенциалът на катода (окислителя) е по-положителен от потенциала на анода (редуктора). Ако металът се разтваря на анода, тогава трябва да имаEOx>gt;EMen+/Me 0 .
Потенциалът на кислородния електрод при 298 K се описва с уравнението:
E0 O2/OH – = 1,23 – pH + lgPO2.
Потенциалът на водородния електрод се описва с уравнението:
E0 2H+/H2= 0.00 – pH + lgPH2.
Графиките на зависимостта са показани на фиг. 7, те могат да се използват за определяне на възможността за корозия на различни метали във водна среда.
Ако потенциалът на метала е по-положителен от потенциала на кислородния електрод (който е +1,2 V в кисела среда при pH = 1 и е около +0,8 V в неутрална среда при pH = 7), тогава корозията на метала е невъзможна (регион III).

Ако потенциалът на метала е по-положителен от потенциала на водородния електрод (последният е нула в кисела среда при pH = 1 и е около -0,41 V в неутрална среда при pH = 7) и по-отрицателен от потенциала на кислородния електрод (регион II), тогава корозията е възможна с абсорбцията на кислород и е невъзможна с отделянето на водород.
Ако потенциалът на метала е по-отрицателен от потенциала на водородния електрод (регион I), тогава е възможна корозия както с абсорбцията на кислород, така и с отделянето на водород. Тези метали включват алкални, алкалоземни, алуминий, цинк и др.
Скоростта на електрохимичната корозия. Действието на галваничните елементи до голяма степен зависи от поляризацията и деполяризацията. В този случай може да възникне както поляризацията на анода, която се изразява в това, че неговият потенциал става по-положителен, така и поляризацията на катода, причинена от отрицателно изместване на неговия потенциал.
Поляризацията намалява многократно скоростта на корозия. Без поляризация много метали, включително желязото, биха корозирали с толкова висока скорост, че биха загубили техническото си значение.
Скоростта на електрохимична корозия може да се определи по формулата:
,
къдетоIе силата на тока, чиято стойност показва скоростта на корозия;Rе омичното съпротивление на електролитния разтвор; Pa е анодната поляризация, Pk е катодната поляризация;E— електродвижеща сила.
В зависимост от това коя от стойностите (R, Pa, Pk) има ограничителен ефект върху скоростта на процеса, се разграничава корозия с различен контрол:
Контролният етап е ограничаващ за целия процес, т.е. ограничава скоростта на корозията като цяло, тъй като протича по-бавно от другите. Възможен е и смесен контрол, когато членовете в знаменателя са приблизително равни по големина.
ЕКСПЕРИМЕНТАЛЕН
Работно съдържание:
1. След запознаване с теоретичния материал направете опити и запишете наблюдения.
2. Във всички експерименти запишете протичащата редокс реакция и процесите на окисление и редукция. Във втория и третия експеримент начертайте диаграма на получените галванични клетки (галванични двойки).