Производство на сярна киселина
Сярната киселина се произвежда в големи количества в заводите за сярна киселина.
Аз. Суровини, използвани за производство на сярна киселина:
II. Подготовка на суровините.
Нека анализираме производството на сярна киселина от пирит FeS2.
1) Смилане на пирит.
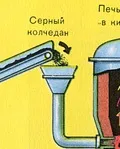
Преди употреба големи парчета пирит се натрошават в трошачки. Знаете, че когато дадено вещество се раздробява, скоростта на реакцията се увеличава, т.к. площта на контакт на реагентите се увеличава.
2) Пречистване на пирит.
След раздробяване на пирит, той се пречиства от примеси (отпадъчни скали и пръст) чрез флотация. За да направите това, натрошеният пирит се спуска в огромни вани с вода, смесва се, отпадъчната скала изплува нагоре, след което отпадъчната скала се отстранява.
III. Химия на производството.
Производството на сярна киселина от пирит се състои от три етапа.
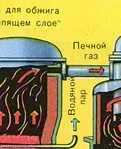
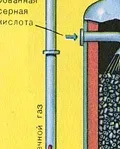
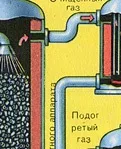
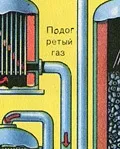
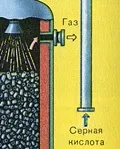
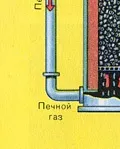
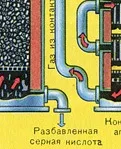
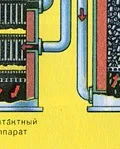
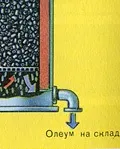
ПЪРВИ ЕТАП - изпичане на пирит в пещ с "кипящ слой".
Уравнение на реакцията на първия етап
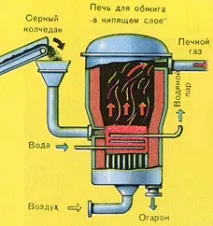
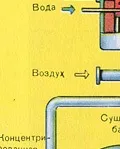
Натрошен, почистен, мокър (след флотация) пирит се излива отгоре в пещ за изпичане в "кипящ слой". Отдолу (принцип на противотока) се пропуска обогатен с кислород въздух за по-пълно изпичане на пирита. Температурата в пещта достига 800°C. Пиритът се нагрява до червено и е в "окачено състояние" поради въздуха, издухван отдолу. Всичко изглежда като кипяща до червено гореща течност.
Благодарение на отделената в резултат на реакцията топлина се поддържа температурата в пещта. излишъкколичеството топлина се отстранява: тръби с вода минават по периметъра на пещта, която се нагрява. Топла вода се използва допълнително за централно отопление на съседни помещения.
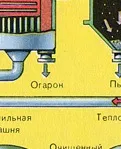
Полученият железен оксид Fe2 O3 (пепел) не се използва при производството на сярна киселина. Но се събира и изпраща в металургичен завод, където желязото и неговите сплави с въглерод се получават от железен оксид - стомана (2% въглерод С в сплавта) и чугун (4% въглерод С в сплавта).
Така се изпълнява принципът на химическото производство – безотпадно производство.
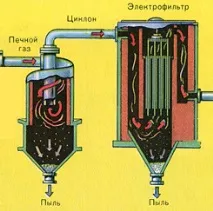
От пещта излиза газ от пещта, чийто състав е: SO2, O2, водна пара (пиритът беше мокър!) И най-малките частици сгурия (железен оксид). Такъв пещен газ трябва да бъде почистен от примеси от твърди частици от сгурия и водна пара.
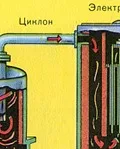
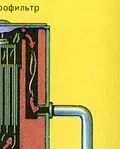
Пречистването на пещния газ от твърди частици сгурия се извършва на два етапа - в циклон (използва се центробежна сила, твърдите частици сгурия се удрят в стените на циклона и падат надолу) и в електростатични утаители (използва се електростатично привличане, частиците от сгурия се придържат към електрифицираните плочи на електростатичния утаител, при достатъчно натрупване под собственото си тегло те падат надолу), за отстраняване на водата ва por в пещния газ (изсушаване на пещния газ) концентрирана сярна киселина, която е много добър изсушаващ агент, защото абсорбира вода.
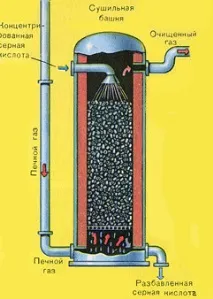
Сушенето на пещния газ се извършва в сушилна кула - пещният газ се издига отдолу нагоре, а концентрираната сярна киселина тече отгоре надолу. На изхода на сушилната кула пещният газ вече не съдържа частици сгурия или водна пара. Пещният газ сега е смес от серен оксид SO2 и кислород O2.
ВТОРИ ЕТАП - окисление на SO2 до SO3 от кислород.
тече в контактаапарат.
Уравнението на реакцията за този етап е: 2SO2 + O2
Сложността на втория етап се състои в това, че процесът на окисляване на един оксид в друг е обратим. Следователно е необходимо да се изберат оптималните условия за директната реакция (получаване на SO3).
Директната реакция е екзотермична +Q, според правилата за изместване на химичното равновесие, за да се измести реакционното равновесие към екзотермична реакция, трябва да се понижи температурата в системата. Но, от друга страна, при ниски температури скоростта на реакцията намалява значително. Експериментално химиците-технолози са установили, че оптималната температура за протичане на директната реакция с максимално образуване на SO3 е температура от 400-500 ° C. Това е сравнително ниска температура в химическата промишленост. За да се увеличи скоростта на реакцията при такава ниска температура, в реакцията се въвежда катализатор. Експериментално е установено, че най-добрият катализатор за този процес е ванадиевият оксид V2O5.
Директната реакция протича с намаляване на обема на газовете: отляво 3V газове (2V SO2 и 1V O2), а отдясно 2V SO3. Тъй като директната реакция протича с намаляване на обема на газовете, тогава, съгласно правилата за изместване на химичното равновесие, налягането в системата трябва да се увеличи. Следователно този процес се извършва при повишено налягане.
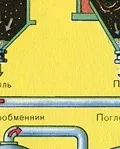
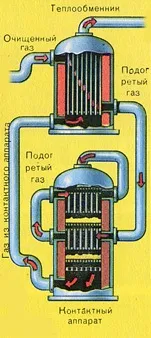
Преди сместа от SO2 и O2 да влезе в контактния апарат, тя трябва да се нагрее до температура 400-500°C. Загряването на сместа започва в топлообменника, който е монтиран пред контактния апарат. Сместа преминава между тръбите на топлообменника и се нагрява от тези тръби. Вътре в тръбите преминава горещ SO3 от контактния апарат. Попадайки в контактния апарат, сместа от SO2 и O2 продължава да се нагрява до желаната температура, преминавайкимежду тръбите в контактния апарат.
Температурата от 400-500 ° C в контактния апарат се поддържа благодарение на отделянето на топлина в реакцията на превръщане на SO2 в SO3. Веднага щом сместа от серен оксид и кислород достигне слоевете на катализатора, започва процесът на окисляване на SO2 до SO3.
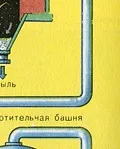
Образуваният серен оксид SO3 напуска контактния апарат и през топлообменника навлиза в абсорбционната кула.
ТРЕТИ ЕТАП - абсорбция на SO3 от сярна киселина.
Тече в абсорбционната кула.
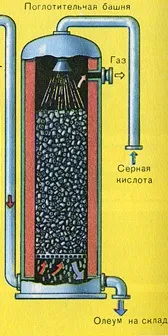
Защо серният оксид SO3 не се абсорбира от водата? В крайна сметка би било възможно да се разтвори серен оксид във вода: SO3 + H2O
Уравнението на реакцията за този процес е nSO3 + H2SO4
Полученият олеум се излива в метални резервоари и се изпраща в склада. След това резервоарите се пълнят с олеум, формират се влакове и се изпращат до потребителя.
Опазване на околната среда,
свързани с производството на сярна киселина.
Основната суровина за производството на сярна киселина е сярата. Той е един от най-често срещаните химически елементи на нашата планета.
Производството на сярна киселина протича на три етапа: първият етап произвежда SO2, чрез изгаряне на FeS2, след това SO3, след което в третия етап се получава сярна киселина.